题目内容
8.在温度,容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:[已知2CO(g)+O2(g)?2CO2(g)△H=-566.0KJ/mol-1]| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
分析 甲容器反应物投入2mol CO、1mol O2,乙容器反应物投入量2mol CO2,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入2mol CO、1mol O2,丙容器反应物投入量4mol CO2,采用极限转化法转化为反应物为4mol CO、2mol O2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,所以丙与甲、乙相比,增大了压强,平衡向着正向移动,所以丙中CO、O2转化率大于甲和乙的,据此进行解答.
解答 解:甲容器反应物投入2mol CO、1mol O2,乙容器反应物投入量2mol CO2,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入2mol CO、1mol O2,丙容器反应物投入量4mol CO2,采用极限转化法转化为反应物为4mol CO、2mol O2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,所以丙与甲、乙相比,增大了压强,平衡向着正向移动,所以丙中CO、O2转化率大于甲和乙的,
A、丙容器反应物投入量4mol CO2,采用极限转化法转化为反应物为4mol CO、2mol O2,是甲中的二倍,若平衡不移动,c3=2c1;丙相当于增大压强,平衡向着正向移动,所以丙中CO2的浓度大于乙中氨气浓度的二倍,即c3>2c1,故A正确;
B、甲投入2mol CO、1mol O2,乙容器反应物投入量2mol CO2,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为566kJ,故a+b=566,故B错误;
C、丙容器反应物投入量4mol CO2,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故C正确;
D、甲容器反应物投入2mol CO、1mol O2,乙容器反应物投入量2mol CO2,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡,所以c1=c2,故D正确;
故选B.
点评 本题考查化学平衡影响因素、等效平衡、化学平衡的计算,题目难度较大,解答的关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.

 计算高手系列答案
计算高手系列答案| A. | NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等 | |
| B. | NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| C. | NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 | |
| D. | NaCl溶液的pH大于NaClO溶液的pH |
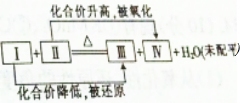 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )| A. | H2SO4 | B. | CuSO4 | C. | Cu | D. | SO2 |
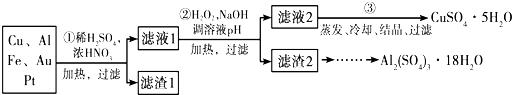

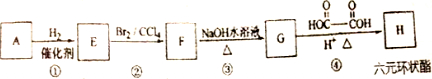
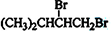 .
. 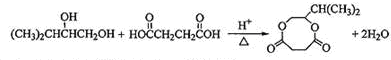 ;
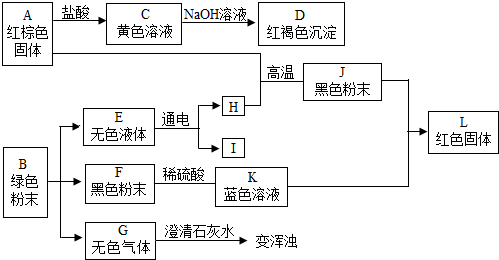
;
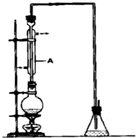 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下:
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.某课外小组欲在实验室制备溴乙烷的装置如右图,实验操怍步骤如下: