题目内容
3.一定量的乙醇在氧气不足的条件下燃烧生成CO、CO2和H2O.全部收集后测得其总质量为55.2g,其中水的质量为21.6g.(1)乙醇的质量为18.4克.
(2)燃烧产物中CO的质量为2.8克.
(3)反应中消耗的O2的质量为36.8克.
分析 (1)根据H原子守恒计算甲醇物质的量,再根据m=nM计算计算甲醇质量;
(2)根据碳原子守恒计算CO、CO2的总的物质的量,令CO、CO2的物质的量分别为xmol、ymol,根据二者质量之和与物质的量之和列方程计算x、y的值,根据m=nM计算CO的质量;
(3)根据质量守恒定律计算消耗氧气质量.
解答 解:(1)n(H2O)=21.6g÷18g/mol=1.2mol,
根据H原子守恒,可知乙醇的物质的量=$\frac{1.2mol×2}{6}$=0.4mol,
则乙醇的质量为0.4mol×46g/mol=18.4g,
故答案为:18.4;
(2)根据C原子守恒,可知CO和CO2的总的物质的量=0.4mol×2=0.8mol,
由于水的质量为21.6g,所以一氧化碳和二氧化碳的质量为:55.2g-21.6g=33.6g,
令CO、CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.8}\\{28x+44y=33.6}\end{array}\right.$
解得x=0.1,y=0.7,
所以原混合气中CO的质量为0.1mol×28g/mol=2.8g,
故答案为:2.8;
(3)根据质量守恒定律,消耗氧气质量=55.2g-18.4g=36.8g,
故答案为:36.8.
点评 本题考查混合物的有关计算,难度中等,关键是抓住化学反应前后原子守恒守恒及质量守恒解答.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
14.查阅相关文章知道,用于测定磷含量的试剂是铝酸铵,化学式为(NH4)2MoO4,请问铝酸铵中铝(Mo)元素化合价为( )
| A. | +6 | B. | +5 | C. | +4 | D. | +3 |
11.下列物质中锰元素的化合价最高的是( )
| A. | MnO2 | B. | MnCl2 | C. | K2MnO4 | D. | KMnO4 |
8.为实现下列实验目的,依据下表提供的主要仪器、所用试剂合理的( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 制备Fe(OH)3胶体 | 烧杯、玻璃棒 | 饱和Na2CO3溶液、0.5mol/L FeCl3溶液 |
| C | 实验室制取NH3 | 试管、带导管的橡皮塞 | 浓氨水、生石灰 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、 0.100 0 mol/L盐酸、酚酞溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为3:4,则甲、乙两烧杯中的反应情况可能分别是( )
| A. | 甲、乙中都是铝过量 | B. | 甲中铝过量,乙中碱过量 | ||
| C. | 甲中酸过量,乙中铝过量 | D. | 甲、乙中都是铝不足 |
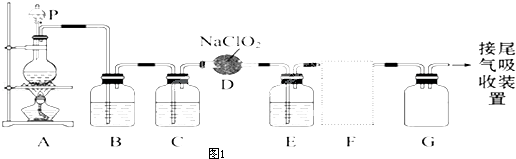
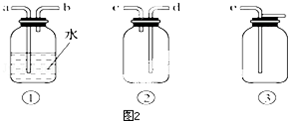
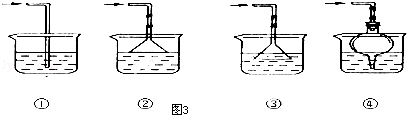
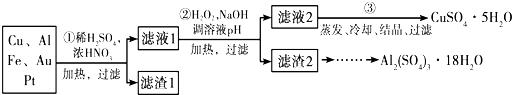


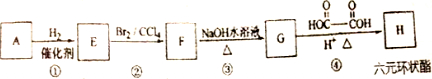
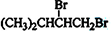 .
. 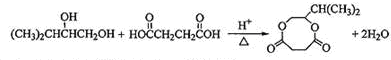 ;
;