题目内容
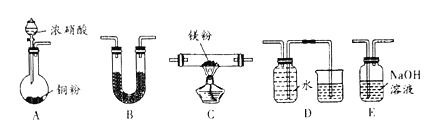
【题目】下图所示装置及药品进行相应实验,能达到实验目的的是

A.图1 定容
B.图2 分离苯和四氯化碳的混合物
C.图3 除去Fe(OH)3胶体中的FeCl3溶液
D.图4 萃取时振摇
【答案】D
【解析】
A. 图1为转移操作,A项错误;
B. 苯和四氯化碳均为有机物,两者互溶,不能用分液的方法进行分离,B项错误;
C.胶体和溶液均可透过滤纸,不能用过滤方法进行分离,应利用渗析法提纯胶体,C项错误;
D.图示为萃取时振摇,操作科学规范,D项正确;
答案选D。
方法 | 课本举例 | 分离的物质 |
过滤 | 除去粗盐中的泥沙 | 用水溶解,从溶液中分离出不溶固体物质 |
蒸发 | 从食盐溶液中分离出NaCl | 加热溶液,从溶液中分离出易溶固体溶质 |
蒸馏 | 从自来水制蒸馏水 | 加热并冷凝,从互溶的液态混合物中分离出沸点不同物质 |
萃取 | 用CCl4提取碘水中碘 | 用一种溶剂把溶质从它与另一溶剂组成的溶液中提取出来 |
洗气 | 用饱和食盐水除去氯气中的氯化氢杂质。 | 气体与气体的分离(杂质气体与液体反应)。 |
升华 | 碘的升华 | 分离易升华的物质。 |

【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为1l;2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HCO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_______,装置A中发生反应的离子方程式_____。
②C瓶溶液中的溶质是NaCl、______(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因_______。
(2)测定C瓶溶液中NaClO含量(单位:g)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为______。
②通常选用______作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_______g/L(保留2位小数)