题目内容
【题目】根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20mi时,以NO表示的平均反应速率= ________,该温度下该反应的平衡常数K=____(保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____(写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
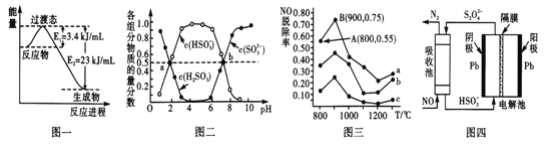
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________,电池总反应式为________________________。
【答案】2CO(g) + O2 (g) = CO2(g) △H=-566 kJ/mol 0.003mol/(L![]() min) 0.56 减小CO2的浓度 AD 2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ SO2+2H2O-2e-=SO42-+4H+ 2SO2+O2+2H2O=2H2SO4或 2SO2+O2+2H2O=4H++2SO42-
min) 0.56 减小CO2的浓度 AD 2Fe3++SO2+2H2O=2Fe2++SO42—+4H+ SO2+2H2O-2e-=SO42-+4H+ 2SO2+O2+2H2O=2H2SO4或 2SO2+O2+2H2O=4H++2SO42-
【解析】
(1)由①CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
②2H2 (g) + O2 (g) = 2H2O (g) △H=-484 kJ/mol,
根据盖斯定律,①![]() 2+②可得:2CO(g) + O2 (g)= CO2(g);
2+②可得:2CO(g) + O2 (g)= CO2(g);
(2)①根据速率公式计算速率;通过表中数据可以知道,反应进行到20-30分钟时达到平衡状态,则K=![]() ;
;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
③A.碳是固体,因此当容器内气体的平均摩尔质量保持不变,说明各组成含量保持不变,即已达平衡;
B、2v(NO)正=v(N2)逆,说明正反应速率和逆反应速率不相等,不能说明反应已达平衡;
C、该反应,反应前后气体分子数不变,所以当容器中气体的压强保持不变,不能说明反应已达平衡;
D、单位时间内生成nmolCO2的同时生成2nmolNO,说明正反应速率和逆反应速率相等,说明反应已达平衡;
(3) SO2转化为SO42-,该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根;
(4)SO2-O2-H2SO4形成燃料电池,通O2的电极为正极发生还原反应,同SO2的电极为负极发生氧化反应,书写电极反应式按照先总后分的顺序,先写出总的原电池方程式,然后写出正极的电极反应式,用总方程式减去正极反应式就是负极的电极反应式。
(1)由①CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
②2H2 (g) + O2 (g) = 2H2O (g) △H=-484 kJ/mol,
根据盖斯定律,①![]() 2+②可得:2CO(g) + O2 (g)= CO2(g) △H=-566 kJ/mol;
2+②可得:2CO(g) + O2 (g)= CO2(g) △H=-566 kJ/mol;
因此,本题正确答案是:2CO(g) + O2 (g)= CO2(g) △H=-566 kJ/mol;
(2)①![]() =
=![]() =
=![]() =0.003mol/(L
=0.003mol/(L![]() min);
min);
反应进行到20-30分钟时达到平衡状态,则K=![]() =
=![]() =0.56;
=0.56;
②根据表中30-40分钟各物质浓度的变化可以看出改变的条件是分离出部分CO2;
③A.碳是固体,因此当容器内气体的平均摩尔质量保持不变,说明各组成含量保持不变,即已达平衡,故A正确;
B、2v(NO)正=v(N2)逆,说明正反应速率和逆反应速率不相等,不能说明反应已达平衡,故B错误;
C、该反应,反应前后气体分子数不变,所以当容器中气体的压强保持不变,不能说明反应已达平衡,故C错误;
D、单位时间内生成nmolCO2的同时生成2nmolNO,说明正反应速率和逆反应速率相等,说明反应已达平衡,故D正确;
因此,本题正确答案是:0.003mol/(L.min); 0.56;减小CO2的浓度
(3) SO2转化为SO42-,该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+;
因此,本题正确答案是:2Fe3++SO2+2H2O=2Fe2++SO42—+4H+;
(4)原电池总方程式为2SO2+O2+2H2O=2H2SO4,正极的电极反应式为O2+4H++4e-=2H2O,用总的减去正极的电极反应式得负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,
因此,本题正确答案是:SO2+2H2O-2e-=SO42-+4H+;2SO2+O2+2H2O=2H2SO4或 2SO2+O2+2H2O=4H++2SO42-。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案