题目内容
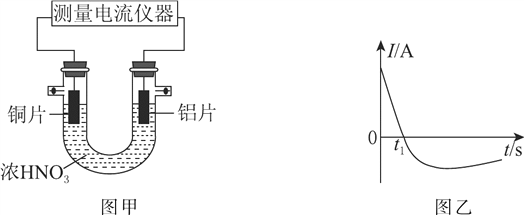
【题目】I 、金属镁性质活泼,能与许多物质反应,某校课外活动小组根据镁能在二氧化碳中燃烧,推测Mg也能在NO2燃烧,可能产物为MgO、N2和Mg3N2。通过如图所示实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。己知:NO2气体能被NaOH吸收,Mg3N2极易与水反应。
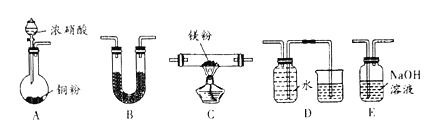
(1)实验中,装置依次连按的顺序为A _________(填字母序号);装置B 的作用是______;
(2)用来检验N2的实验装置为__________(填字母序号);
(3)设计实验证明:产物中存在Mg3N2 ____________;
Ⅱ、工业上以菱镁矿为原料(主要成分为MgCO3,还有SiO2、FeCO3等杂质)制备纳米氧化镁。
(4)根据反应流程要求,先除去FeCO3,采用先酸浸再氧化的方法,其中加入H2O2时,发生反应的离子方程式为__________。
(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,流程后期,当除杂完成后,再加入CO(NH2)2 开始沉淀Mg2+,该过程中发生的两个主要反应为(用化学方程式或离子反应方程式表示)___________;___________。
【答案】 BCBED 在C的两侧防止水蒸气进入C中 D 取C中少量反应产物,加入到水中产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝。 2Fe2++H2O2+2H+![]() 2Fe3++2H2O CO(NH2) 2+3H2O
2Fe3++2H2O CO(NH2) 2+3H2O![]() CO2+2NH3·H2O Mg2++2NH3·H2O= Mg(OH)2↓+2NH4+
CO2+2NH3·H2O Mg2++2NH3·H2O= Mg(OH)2↓+2NH4+
【解析】(1)Mg能在NO2中燃烧,产物为Mg3N2、Mg0和N2,装置A中Cu与浓硝酸反应生成的气体NO2,用装置B干燥剂干燥,通入硬质玻璃管C与镁粉发生反应,用E装置除去多余的NO2,装置D排水法收集N2,为防止E中的水份进入装置使氮化镁水解,在E装置前也要连B装置干燥,故连接装置的顺序为:ABCBED;根据以上分析可知装置B 的作用是在C的两侧防止水蒸气进入C中;(2)根据以上分析可知用来检验N2的实验装置为D;(3)氮化镁能与水反应生成氢氧化镁和氨气,则检验氮化镁的实验操作为:取少量反应后的固体产物,加入到水中产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变成蓝色;(4)双氧水具有强氧化性,能氧化溶液中的亚铁离子,方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(5)已知:在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,根据原子守恒可知弱碱是一水合氨,方程式为CO(NH2) 2+3H2O![]() CO2+2NH3·H2O;产生的氨水能与镁离子结合生成氢氧化镁沉淀,方程式为Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+。
CO2+2NH3·H2O;产生的氨水能与镁离子结合生成氢氧化镁沉淀,方程式为Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+。

【题目】下列有关反应热的叙述中正确的是( )
①下表数据可以计算出 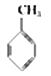 (g)+3H2(g)→
(g)+3H2(g)→ 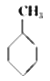 (g)的反应热;
(g)的反应热;
共价键 | C﹣C | C═C | C﹣H | H﹣H |
键能/(kJmol﹣1) | 348 | 610 | 413 | 436 |
②已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1, 则氢气的燃烧热为△H=﹣241.8kJmol﹣1
③由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
④X(g)+Y(g)═Z(g)+W(s)△H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大
⑤由盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1molCO2固体时,放出的热量相等;
⑥25℃,101kPa时,1mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热.
A. ①②③④ B. ③④⑤ C. ④⑤ D. ⑥