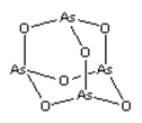
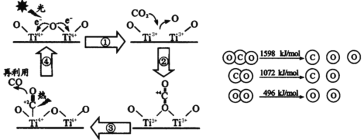
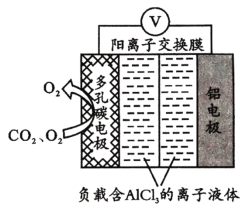
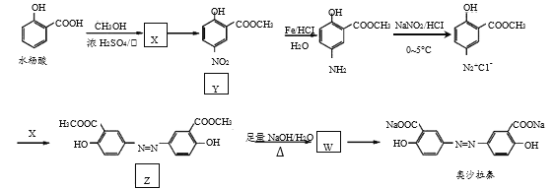
题目内容
【题目】阿伏加德罗常数的值为NA。下列说法正确的是( )
A.标准状况下,3.36L的氦气中含有0.6NA个中子
B.6.5gZn与足量浓H2SO4完全反应,产生气体的分子数为0.1NA
C.标准状况下,2.24L的乙酸在O2中完全燃烧,得到0.2NA个CO2分子
D.1molFe与足量稀硝酸充分反应后,转移电子数为2NA
【答案】B
【解析】
A.氦气为单原子分子,其质量数是4,一个氦气分子中共含2个质子,2个中子,标准状况下,3.36L的氦气的物质的量为![]() =0.15mol,含有中子数为0.15mol×2×NA=0.3NA个,故A错误;
=0.15mol,含有中子数为0.15mol×2×NA=0.3NA个,故A错误;
B.6.5gZn与足量浓H2SO4完全反应生成二氧化硫,化学反应方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,6.5gZn的物质的量为0.1mol,则生成SO2的物质的量为0.1mol,产生SO2气体的分子数为0.1NA,故B正确;
C.标准状况下,乙酸为液体,不能用标况下气体摩尔体积计算乙酸的物质的量,则完全燃烧产生的CO2的物质的量无法确定,CO2分子数目也无法确定,故C错误;
D.稀硝酸具有强氧化性,1molFe与足量稀硝酸充分反应后生成硝酸铁,反应中Fe元素由0价变为+3价,1molFe完全反应转移3mol电子,则转移电子数为3NA,故D错误;
答案选B。

【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
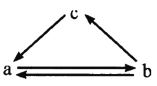
选项物质 | a | b | c |
A | Na2 CO3 | NaHCO3 | CO2 |
B | NO | NO2 | HNO3 |
C | FeCl3 | FeCl2 | Fe |
D | Al2O3 | Al(OH)3 | AlCl3 |
A.AB.BC.CD.D
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D