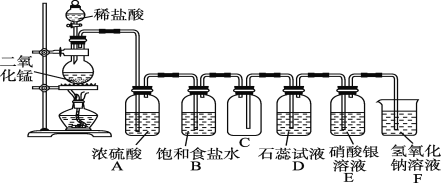
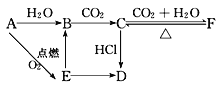
题目内容
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,则a+b>c+d
B.若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为a:b
C.若平衡体系中共有气体M mol,再向其中充入bmolB,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若从正反应开始,A、B的初始物质的量之比为1:1,则平衡时A、B的转化率一定相等
【答案】B
【解析】
A. 温度不变,容器体积扩大一倍,此时A的浓度是原来的0.45倍,说明降低压强,平衡向正反应移动,降低压强平衡向气体体积增大的方向移动,故a+b<c+d,A项错误;
B. 若从正反应开始,平衡时A、B的转化率相等,由于转化A、B的物质的量之比等于a:b,所以A、B的初始物质的量之比为a:b,B项正确;
C. 平衡体系中共有气体M mol,再向其中充入b mol B,平衡向正反应移动,达到平衡时气体总物质的量为(M+b) mol,混合气体的总的物质的量不变,故反应前后气体的化学计量数之和相等,即a+b=c+d,C项错误;
D. 若从正反应开始,A、B的初始物质的量之比为1:1,若a:b不是1:1,则转化的A与B物质的量之比不是1:1,平衡时A、B的转化率不相等,D项错误;
答案选B。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=a kJ·mol-1其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g) ΔH=a kJ·mol-1其化学平衡常数K和温度t的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
下列说法中正确的是( )
A.该反应的正反应为放热反应,即a<0
B.当平衡浓度符合c(CO2)·c(H2)=c(CO)·c(H2O)时的温度为830 ℃
C.当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动
D.当v正(H2)=v正(H2O)时该反应达到化学平衡状态