题目内容
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
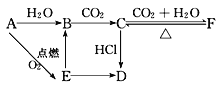
(1)写出A、B、C、D、E、F的化学式:A.__________;B.__________;C.__________;D.__________;E.__________;F.__________。
(2)写出有关反应的离子方程式
B→C:__________________________________。
E→B:___________________________________。
C→F:___________________________________。
(3)写出F→C的化学方程式:______________________。
【答案】Na NaOH Na2CO3 NaCl Na2O2 NaHCO3 2OH-+CO2=CO32-+H2O 2Na2O2+2H2O=4Na++4OH-+O2↑ CO32-+H2O+CO2=2HCO3- 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
A与氧气反应生成淡黄色粉末E为Na2O2,则A为Na,钠与水反应生成B且也能由过氧化钠转化得到,可推知B为NaOH,由于NaOH与二氧化碳得到C,C与二氧化碳、水反应得到F,可推知C为Na2CO3、F为NaHCO3,碳酸钠与HCl反应得到固体D,且能由过氧化钠转化得到,可推知D为NaCl,据此解答。
(1)由上述推断可知:A为Na,B为NaOH,C为Na2CO3、D为NaCl,E为Na2O2,F为NaHCO3;
(2)B→C是氢氧化钠与少量二氧化碳反应生成碳酸钠与水,反应的离子方程式为:2OH-+CO2=CO32-+H2O;
E→B是过氧化钠与水反应生成氢氧化钠与氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
C→F是碳酸钠与二氧化碳、水反应生成碳酸氢钠,反应的离子方程式为:CO32-+H2O+CO2=2HCO3-;
(3)F→C是碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应的化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。

 名校课堂系列答案
名校课堂系列答案