题目内容
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ·mol-1。
(1)写出甲醚燃烧的热化学方程式____;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;计算反应:4C(s)+6H2(g)+O2(g)=2CH3OCH3(g)的反应热为____。
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应。下列能判断反应达到化学平衡状态的是____
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1molH2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将___(填“变大”、“变小”或“不变”)
【答案】CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol 338.8 kJ/mol ad 变小
【解析】
(1)依据燃烧热的含义,结合书写方法写出热化学方程式;依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(2)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断。
②根据反应放热,结合温度对平衡的影响作答。
(1)甲醚完全燃烧生成二氧化碳和液态水,因燃烧热为1455kJ/mol,则甲醚燃烧的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol;
H2(g)和C(s)的燃烧热分别是285.8kJmol1、393.5kJmol1,由此写出热化学方程式:
①H2(g)+1/2O2(g)=H2O(l) △H1=285.8 kJ/mol;
②C(s)+O2(g)=CO2(g) △H2=393.5 kJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H3=1455kJ/mol;
依据盖斯定律计算①×3+②×2③得到反应热化学方程式为:2C(s)+3H2(g)+1/2O2(g)═CH3OCH3(g) △H=169.4 kJ/mol;
则4C(s)+6H2(g)+O2(g)═2CH3OCH3(g) △H=338.8 kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455kJ/mol;338.8 kJ/mol;
(2)①a.在反应达平衡前,c(H2)与c(H2O)的比值在变小,故当c(H2)与c(H2O)的比值保持不变时,能说明反应达平衡;
b.单位时间内有2mol H2消耗时一定会有1mol H2O生成,故不能作为平衡的标志;
c.该反应的反应物和生成物全是气体,根据质量守恒可知,在反应过程中气体的质量一直不变,而又是恒容的容器,即气体体积不变,故气体密度ρ=m/V一直不变,故密度不变不能作为平衡的标志;
d.此反应是气体的物质的量有改变的反应,即在平衡之前,容器中气体的物质的量和压强在变化,故当压强不变时,说明反应达平衡;
故答案为:ad;
②反应放热,故升高温度,平衡向逆反应方向移动,故CH3OCH3的产率将变小,故答案为:变小。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
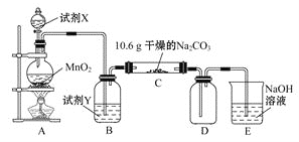
(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加BaCl2溶液 | __________________ |
步骤3:______________ | __________________ |
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。