题目内容
7.用下列实验装置进行相应实验,能达到实验目的是( )| A. | 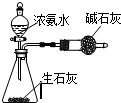 此图:制少量干燥的NH3 | |
| B. | 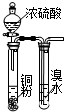 此图:验证浓硫酸具有强氧化性 | |
| C. | 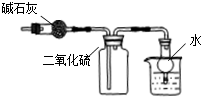 此图:干燥、收集并吸收多余SO2 | |
| D. | 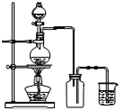 此图:实验室用MnO2和浓盐酸制取Cl2 |
分析 A.氧化钙与水反应是放热反应;
B.浓硫酸与铜粉常温下不反应;
C.二氧化硫是酸性气体;
D.氯气密度比空气大.
解答 解:A.氧化钙与水反应是放热反应,可用浓氨水和氧化钙制取氨气,故A正确;
B.浓硫酸与铜粉常温下不反应,加热才反应,故B错误;
C.二氧化硫是酸性气体,不能用碱石灰干燥,故C错误;
D.氯气密度比空气大,应用向上排空气法收集,故D错误.
故选A.
点评 本题考查化学实验方案的评价,涉及物质的制备、分离和检验等实验操作,侧重于物质性质的考查,题目难度不大.

练习册系列答案
相关题目
17.甲~辛等元素在元素周期表中的相对位置如下表所示,已知甲是IA族元素,乙与己同周期,己单质在暗处与H2剧烈化合并发生爆炸.下列判断正确的是:( )


| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
18. 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,K1<K2=1.5 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
2.下列装置或操作能达到实验目的是( )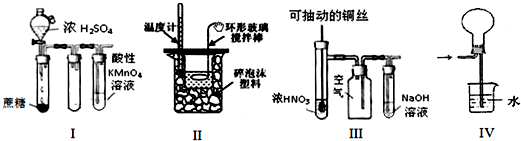

| A. | 实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. | 实验Ⅱ:中和热测定 | |
| C. | 实验Ⅲ:可用来制取并收集NO2 | |
| D. | 实验Ⅳ:可用于HCl气体的吸收 |
12.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知摩尔盐在隔绝空气的条件下加热至500°C时可完全分解.根据所学知识和有关原理分析,其分解产物肯定不正确的是( )
| A. | Fe2O3 SO2 NH3 H2O | B. | FeO SO3 NH3 H2O | ||
| C. | Fe2O3 SO2 SO3NH3 H2O | D. | FeO SO2 NH3 H2O |
19.用NH3催化还原NxOy可以消除氮氧化物的污染.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
(1)△H3=△H1-3△H2(用△H1、△H2的代数式表示);推测反应III是吸热反应(填“吸热”或“放热”)
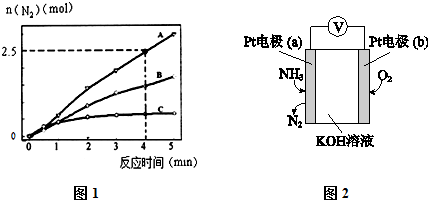
(2)相同条件下,反应Ⅰ在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,NO2体积分数不变(填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图2. 溶液中OH-向电极a移动(填a或b),负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
已知:反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应Ⅰ和反应Ⅱ在不同温度时的平衡常数及其大小关系如下表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应Ⅰ在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.在其它条件不变时,再充入NO2气体,NO2体积分数不变(填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图2. 溶液中OH-向电极a移动(填a或b),负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
