题目内容
11.在我校食堂南侧的绿树青草间,有一井水形成的弯弯小溪.近来发现,昔日那碧波澄清的水面上,泛起了棕红色的“水锈”,小煞风景.(1)根据学过的知识,你认为该“水锈”的主要成分可能是(写化学式)Fe2O3.
(2)怎样用化学方法检验此“水锈”的主要成分?简述实验操作:
第一步:取含“水锈”的混浊液少许于试管;
第二步:加适量盐酸溶解;
第三步:加硫氰化钾溶液出现血红色.
上述有关反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O、Fe3++3SCN-=Fe(SCN)3.
分析 (1)由棕红色的“水锈”可知,物质的颜色为红色;
(2)检验此“水锈”的主要成分,可检验铁离子,加KSCN溶液变为血红色即可检验.
解答 解:(1)由棕红色的“水锈”可知,物质的颜色为红色,结合常见铁的化合物的颜色可知该物质为Fe2O3,故答案为:Fe2O3;
(2)检验此“水锈”的主要成分的操作为第一步:取含“水锈”的混浊液少许于试管;
第二步:加适量盐酸溶解,发生Fe2O3+6H+=2Fe3++3H2O;
第三步:加硫氰化钾溶液出现血红色,发生Fe3++3SCN-=Fe(SCN)3,
故答案为:加适量盐酸溶解;加硫氰化钾溶液出现血红色;Fe2O3+6H+=2Fe3++3H2O;Fe3++3SCN-=Fe(SCN)3.
点评 本题考查物质的检验和鉴别,为高考常见题型,侧重于学生实验能力和综合运用化学知识的能力的考查,注意把握铁的化合物颜色及铁离子检验方法,题目难度不大.

练习册系列答案
相关题目
7.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 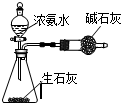 此图:制少量干燥的NH3 | |
| B. | 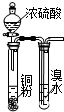 此图:验证浓硫酸具有强氧化性 | |
| C. | 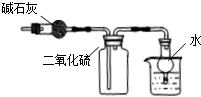 此图:干燥、收集并吸收多余SO2 | |
| D. | 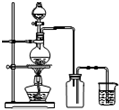 此图:实验室用MnO2和浓盐酸制取Cl2 |
19.下列物质中,能发生消去反应的是( )
| A. | CH3OH | B. | CH3CH2CH2OH | C. | 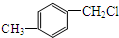 | D. | 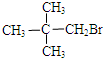 |
6.已知:
HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ•mol-1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-b kJ•mol-1,
则a、b 二者的大小关系为( )
HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l);△H=-a kJ•mol-1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-b kJ•mol-1,
则a、b 二者的大小关系为( )
| A. | a>b | B. | b>a | C. | a=b | D. | 无法判断 |
16.关于食品添加剂,下列说法中,正确的是( )
| A. | 为了让食品保存得更长一些,可以多加一些添加剂 | |
| B. | 在国家卫生部门规定的范围内使用食品添加剂,一般认为对人体无害 | |
| C. | 染衣服的染料也可以用给食品染色 | |
| D. | 某腌制的肉类颜色鲜红,说明该食品既新鲜又安全 |
20.据报导用激光将置于铁室中的石墨靶上的碳原子“炸松”,与此同时再用一个射频电火花喷射出氮气,此时碳、氮原子结合成碳氮化合物的薄膜,该膜的硬度可比金刚石更坚硬,其原因可能是( )
| A. | 碳、氮原子构成网状的原子晶体 | |
| B. | 膜中的C-N键长比金刚石的C-C键长短 | |
| C. | 碳、氮都是非金属,化合时放出大量热 | |
| D. | 相邻主族非金属的化合物比单质硬度大 |
1.下列说法正确的是( )
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 用新制氢氧化铜悬浊液不能鉴别乙醇溶液和葡萄糖溶液 |