题目内容
18.如图装置闭合电键K时,电流计A的指针将发生偏转.试回答: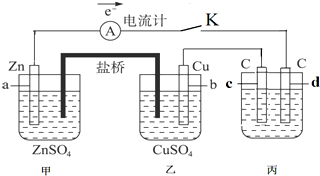
(1)若用此装置在铁制品上镀铜,在丙装置中,电极d应换成铁制品.
(2)若丙池中的电解液为NaCl溶液,则电解时的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)若丙池中的电解液为CuSO4溶液,则阳极的电极反应式为4OH--4e-=2H2O+O2↑,电解时的化学反应方程式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)若丙池中的电解液为500毫升1mol/L含CuSO4的NaCl溶液,当两极都生成11.2L(标况下)气体时,则丙池中CuSO4溶液的物质的量浓度是0.5mol/L.(忽略反应过程当中的体积变化)
分析 (1)甲和乙形成原电池,所以丙属于电解池;甲中a失电子为负极;丙中c电极连接原电池的正极属于阳极;
(2)丙池中是电解NaCl溶液生产氢气,氯气和氢氧化钠;
(3)电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成Cu;
(4)用C电极电解500mL含CuSO4和NaCl混合溶液,溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氯离子失电子生成氯气:2Cl--2e-=Cl2↑,氢氧根离子放电生成氧气4OH--4e-=2H2O+O2↑,阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,依据两极生成气体物质的量结合电解过程中电子守恒计算便可求解.
解答 解:(1)甲和乙形成原电池,所以丙属于电解池;甲中a失电子为负极;丙中c电极连接原电池的正极属于阳极,用此装置在铁制品上镀铜,d应为镀件铁制品,故答案为:铁制品;
(2)丙池中是电解NaCl溶液生产氢气,氯气和氢氧化钠,其电解方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;
(3)用惰性电解电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电生成铜,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:4OH--4e-=2H2O+O2↑;2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(4)已知n(H2)=n(Cl2)+n(O2)=0.5mol,500毫升1mol/L含CuSO4的NaCl溶液中含n(Cl-)=0.5mol,生成氯气0.25mol,转移电子0.5mol,则生成氧气0.25mol,转移电子1.0mol,阳极上共失电子1.5mol,则阴极上得电子1.5mol,生成0.5mol氢气需要电子1.0mol,则Cu2++2e-=Cu转移电子为0.5mol,有铜离子0.25mol,$\frac{0.25mol}{0.5L}$=0.5mol/L,故答案为:0.5mol/L.
点评 该题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题.试题综合性强,难易适中,贴近高考,有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,提高学生学习效率.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向正反应方向移动了 | D. | a>b |
| A. | 硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
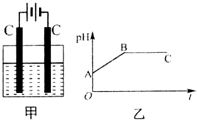 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A. | 是该混合溶液中的SO42-导致了A点溶液的pH值小于B点 | |
| B. | BC段阴极产物和阳极产物的体积之比为2:1 | |
| C. | AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu | |
| D. | 在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
| A. | H2O2的电子式: | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 乙酸分子的球棍模型: | |
| D. | 离子结构示意图 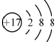 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
