题目内容
8.甲醇被称为2l世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)…I,CH4的转化率与温度、压强的关系如图1.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1.
②图中的P1<P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4.
③在其它条件不变时降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)…Ⅱ.
④该反应的△H<0,△S<0(填“<”、“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离出来C.充入He,使体系总压强增大 D.再充入l mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中.
| 实验编号 | T(℃) | n (C)/n | P(MPa) |
| Ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| Ⅱ | 150 | $\frac{1}{3}$ | 5 |
| Ⅲ | 350 | $\frac{1}{3}$ | 5 |
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图2,并标明各条曲线的压强.
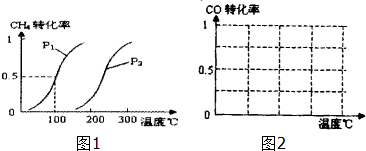
分析 (1)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①根据v=$\frac{△c}{△t}$计算用H2表示的平均反应速率;
②相同温度时,增大压强平衡逆向移动,甲烷的转化率减小;根据K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$计算平衡常数;
③在其它条件不变时降低温度,正逆反应速率都减小;
(2)④正反应气体物质的量减小,混乱度减小,即为熵减的反应,在催化剂作用下能自发反应,说明正反应为焓减的放热反应;
⑤A.正反应为放热反应,升高温度平衡逆向移动;
B.将CH3OH(g)从体系中分离出来,平衡正向移动;
C.充入He,使体系总压强增大,反应混合物各组分浓度不变,平衡不移动;
D.再充入l mol CO和3mol H2,反应物浓度增大,平衡正向移动,等效为增大压强,反应物转化率增大;
⑥目的是探究温度、压强的适宜条件,应采取控制变量法,I为对照实验,Ⅱ与I的压强不同,Ⅲ与I的温度不同,其它条件应相同;
一定温度下,增大压强,平衡正向移动,平衡时CO的转化率降低;压强一定时,由于正反应为放热反应,升高温度平衡逆向移动,CO的转化率减小.
解答 解:(1)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①H2表示的平均反应速率=$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,故答案为:0.003 mol•L-1•min-1;
②相同温度时,增大压强平衡逆向移动,甲烷的转化率减小,则P1<P2,
平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=$\frac{0.005×0.01{5}^{3}}{0.005×0.015}$=2.25×10-4,
故答案为:2.25×10-4;
③在其它条件不变时降低温度,正逆反应速率都减小,故答案为:减小;
(2)④正反应气体物质的量减小,混乱度减小,则△S<0,在催化剂作用下能自发反应,说明正反应为焓减的放热反应,即△H<0,
故选:<;<;
⑤A.正反应为放热反应,升高温度平衡逆向移动,甲醇产率减小,故A正确;
B.将CH3OH(g)从体系中分离出来,平衡正向移动,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,反应混合物各组分浓度不变,平衡不移动,甲醇产率不变,故C错误;
D.再充入l mol CO和3mol H2,反应物浓度增大,平衡正向移动,等效为增大压强,反应物转化率增大,则甲醇产率增大,故D正确;
⑥目的是探究温度、压强的适宜条件,应采取控制变量法,I为对照实验,Ⅱ与I的压强不同,Ⅲ与I的温度不同,其它条件应相同,故实验I温度为150℃,n(C)=$\frac{1}{3}$,实验Ⅲ中n(C)=$\frac{1}{3}$;
一定温度下,增大压强,平衡正向移动,平衡时CO的转化率降低;压强一定时,由于正反应为放热反应,升高温度平衡逆向移动,CO的转化率减小,0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图为: ,
,
故答案为:
| 实验编号 | T(℃) | n (C)/n | P(MPa) |
| Ⅰ | |||
| Ⅱ | 150 | $\frac{1}{3}$ | |
| Ⅲ | $\frac{1}{3}$ |
 .
.点评 本题考查化学平衡计算与影响因素、平衡常数、探究外界条件对平衡的影响等,注意利用控制变量法分析探究外界条件对平衡影响,难度中等.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
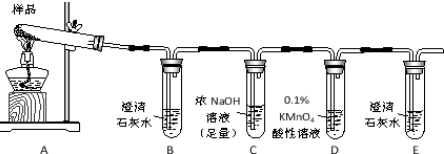
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
| A. | 烧杯、酒精灯、试管、铁架台(铁圈)、漏斗 | |
| B. | 烧杯、漏斗、玻璃棒、铁架台(铁圈)、滤纸 | |
| C. | 滤纸、烧杯、试管夹、漏斗、玻璃棒 | |
| D. | 滤纸、试管、漏斗、铁架台(铁圈)、玻璃棒 |
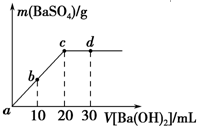 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )| A. | 硫酸溶液的体积为20mL | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.083mol•L-1 | |
| C. | d时刻溶液的pH为12 | |
| D. | 反应的离子反应方程式为Ba2++SO4-+2H++2OH-═BaSO4↓+2H2O |
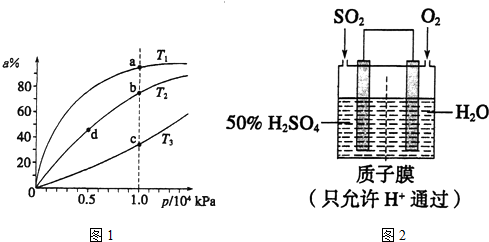
 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.