题目内容
【题目】某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
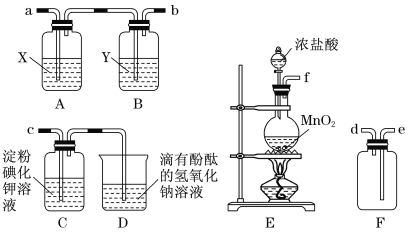
请回答下列问题:
(1)整套实验装置的连接顺序是f接( ) ( )接( )( )接( )(各接口处的字母代号)。_________
(2)E装置中制取氯气的离子方程式是_________________________。
(3)B装置的作用是__________________;A装置中试剂X是________________。
(4)C装置中可观察到的现象是____________。
(5)ClO2和氯气具有相似的性质,用如图装置可以测定某混合气中ClO2 的含量:(其他成分不参与反应)
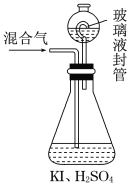
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂
显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
A. 锥形瓶内ClO2与碘化钾反应的离子方程式为__________________________________。
B. 测得混合气中ClO2的质量为________g。
【答案】a b e d cMnO2+4H++2Cl-![]() Mn2 ++Cl2↑+2H2O干燥Cl2饱和食盐水溶液变蓝色2ClO2+10I-+8H+===5I2+4H2O+2Cl-0.027 00
Mn2 ++Cl2↑+2H2O干燥Cl2饱和食盐水溶液变蓝色2ClO2+10I-+8H+===5I2+4H2O+2Cl-0.027 00
【解析】
(1)本实验目的是制取、收集纯净干燥的氯气,并探究氯气的性质,即E装置为制取氯气装置,E制备的氯气中混有HCl和水蒸气,先通过饱和食盐水吸收HCl,然后通过浓硫酸吸收水蒸气,即E接A接B,从B装置出来的气体为干燥纯净的氯气,然后进行收集,F为收集装置,C装置验证氯气的性质,因此连接顺序是f→a→b→e→d→c;(2)MnO2和浓盐酸反应的离子方程式为MnO2+4H++2Cl-![]() Mn2 ++Cl2↑+2H2O;(3)根据上述分析,B装置的作用是干燥氯气,A装置的作用是吸收HCl,应盛放饱和食盐水;(4)氯气的氧化性强于I2,发生Cl2+2I-=2Cl-+I2,淀粉遇碘单质变蓝,因此溶液变为蓝色;(5)A.根据实验V,ClO2把I-氧化成I2,本身被还原成Cl-,因此离子反应方程式为2ClO2+10I-+8H+=5I2+4H2O+2Cl-;B.根据发生反应方程式,建立关系式:2ClO2~5I2~10S2O32-,n(ClO2)=n(S2O32-)/5=20×10-3×0.1000/5mol=4×10-4mol,即ClO2的质量为4×10-4×67.5g=0.02700g。
Mn2 ++Cl2↑+2H2O;(3)根据上述分析,B装置的作用是干燥氯气,A装置的作用是吸收HCl,应盛放饱和食盐水;(4)氯气的氧化性强于I2,发生Cl2+2I-=2Cl-+I2,淀粉遇碘单质变蓝,因此溶液变为蓝色;(5)A.根据实验V,ClO2把I-氧化成I2,本身被还原成Cl-,因此离子反应方程式为2ClO2+10I-+8H+=5I2+4H2O+2Cl-;B.根据发生反应方程式,建立关系式:2ClO2~5I2~10S2O32-,n(ClO2)=n(S2O32-)/5=20×10-3×0.1000/5mol=4×10-4mol,即ClO2的质量为4×10-4×67.5g=0.02700g。

【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:________________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为__________。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)__________。三种元素电负性由大到小的顺序为(填元素符号)_____________。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)__________,原因是________________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:________________。
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是________________。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |

