题目内容
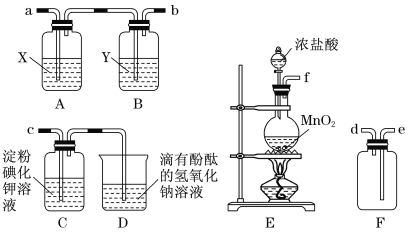
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
【答案】C
【解析】
A、氯气是有毒气体不能直接排放到空气中,G装置中的氢氧化钠溶液能与氯气反应而除去多余氯气,防止空气污染,选项A正确;B、因为AlCl3易水解,所以铝和氯气反应必须在干燥的环境下进行,因此装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中,选项B正确;C、用50mL12mol/L的盐酸与足量的MnO2反应,由于浓盐酸不断消耗,变为稀盐酸,与二氧化锰不反应,所以50mL12mol/L的盐酸产生氯气的量小于0.15mol,因此氯气与铝反应生成氯化铝的量少于0.1 mol,质量小于13.35g,选项C错误;D、实验过程中应先点燃A处的酒精灯,反应产生氯气,利用氯气排净装置内的空气,待装置中充满黄绿色气体时再点燃D处的酒精灯,反应进行,选项D正确;答案选C。

练习册系列答案
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
【题目】下列陈述I、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 干燥的氯气有强氧化性 | 氯水能使有色布条褪色 |
B | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | 用淀粉-KI溶液鉴别FeCl2 | Fe2+有氧化性 |
A. A B. B C. C D. D