题目内容
18.(1)现有ag某气体AB2,它的摩尔质量为Mg•mol-1.若阿伏加德罗常数用NA表示,则:该气体的物质的量为$\frac{a}{M}$mol;该气体所含原子总数为$\frac{3a{N}_{A}}{M}$个;该气体在标准状况下的体积为$\frac{22.4a}{M}$L.该气体一个分子的质量为$\frac{M}{{N}_{A}}$g.(2)805g Na2SO4•10H2O中所含的Na+的物质的量是5mol、SO42-的物质的量是2.5mol,所含H2O分子的数目是25NA个.
分析 (1)由质量与摩尔质量的关系计算出物质的量,再根据阿伏伽德罗常数与离子数关系计算出该气体含有的原子数;根据标况下的气体摩尔体积计算出标况下mg气体的体积;1mol该分子的质量为Mg,即可求出一个分子的质量.
(2)根据n=$\frac{m}{M}$计算Na2SO4•10H2O的物质的量,Na+的物质的量是Na2SO4•10H2O的物质的量的2倍,SO42-的物质的量等于Na2SO4•10H2O的物质的量,所含H2O分子的物质的量是Na2SO4•10H2O的物质的量的10倍,根据N=nNA计算H2O分子的数目.
解答 解:(1)现有ag某气体AB2,它的摩尔质量为Mg•mol-1.若阿伏加德罗常数用NA表示,则:该气体的物质的量为:n=$\frac{a}{M}$mol,含有原子的物质的量为=$\frac{a}{M}$mol×3=$\frac{3a}{M}$mol,该气体所含原子总数为:N=$\frac{3a}{M}$mol×NA=$\frac{3a{N}_{A}}{M}$,该气体在标准状况下的体积为V=nVm=$\frac{22.4a}{M}$L.该气体一个分子的质量为$\frac{M}{{N}_{A}}$g;
故答案为:$\frac{a}{M}$;$\frac{3a{N}_{A}}{M}$;$\frac{22.4a}{M}$;$\frac{M}{{N}_{A}}$;
(2)Na2SO4•10H2O的相对分子质量为322,故Na2SO4•10H2O的摩尔质量是322g/mol,805g Na2SO4•10H2O的物质的量是$\frac{805g}{322g/mol}$=2.5mol,含有钠离子的物质的量为2.5mol×2=5mol,SO42-的物质的量等于Na2SO4•10H2O的物质的量2.5mol,含有水分子的物质的量为2.5mol×10=25mol,水分子的数目为25mol×NAmol-1=25NA,
故答案为:5mol;2.5mol;25NA.
点评 本题考查了有关物质的量的简单计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量等物理量之间的转化关系.

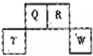 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )| A. | W在周期表中的位置是第三周期,ⅤA族 | |
| B. | 原子半径Q>R>T | |
| C. | W原子得电子能力强于Q原子,且可形成共价化合物QW2 | |
| D. | 原子序数比R多1的元素只有一种氢化物 |
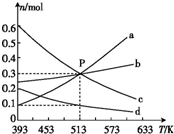 在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )
在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )| A. | △H<0 | |
| B. | 图中曲线a表示H2(g)的变化 | |
| C. | P点时,平衡常数值约为333.3 | |
| D. | 513 K时,向上述容器中充入n(H2)=0.6 mol,n(CO2)=0.2 mol,n(C2H4)=0.6 mol,n(H2O)=0.6 mol,则达到平衡时氢气的体积分数比P点时的小 |
| A. | 将水加热到100℃时,水的pH=6 | B. | 向水中滴加少量稀H2SO4 | ||
| C. | 向水中加入少量NaHCO3 | D. | 向水中加入少量胆矾晶体 |
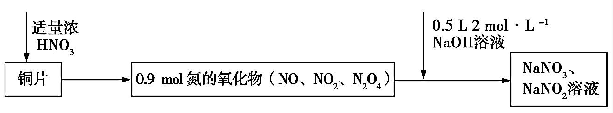
| A. | 若铜片为51.2 g,则生成0.2 mol NaNO3 | |
| B. | 常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16 L | |
| D. | 反应过程中生成的Cu(NO3)2 既是氧化产物,也是还原产物 |
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同. .
.