题目内容
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是___________(用元素符号填空),基态D原子价电子的轨道表达式为______。
(2)DA2分子的VSEPR模型是___________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于______晶体(填晶体类型),其中C原子的杂化轨道类型为____杂化。

②[C(OH)4]-中存在的化学键有________。
⑷B、C的氟化物晶格能分别是2957 kJ·mol-1 、5492 kJ·mol-1 ,二者相差很大的原因是____________。
(5)D与E形成化合物晶体的晶胞如下图所示:

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2);c为(1/2,1/2,0)。则d原子的坐标参数为_______。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____pm(列出计算式即可)。
【答案】 镁(或Mg) ![]() 平面三角形 分子 sp3 极性共价键、配位键 Al3+比Mg2+电荷多,半径小 4 (1,
平面三角形 分子 sp3 极性共价键、配位键 Al3+比Mg2+电荷多,半径小 4 (1,![]() ,
,![]() ) 【答题空10】
) 【答题空10】![]() ×
×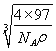 ×1010
×1010
【解析】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3则D为S,A为O;B、E除最外层均只有2个电子外,其余各层全充满,则B为Mg,E位于元素周期表的ds区则E为Zn。工业上电解熔融C2A3制取单质C,则C为Al;B、E除最外层均只有2个电子外,其余各层全充满,则B为Mg,E位于元素周期表的ds区则E为Zn。
(1)镁原子的3s为全充满状态,较为稳定,第一电离能大于铝原子,基态S原子价电子的轨道表达式为![]() ,故答案为:镁;
,故答案为:镁;![]() ;
;
(2)SO2分子的价层电子对数为2+![]() =3,二氧化硫分子的VSEPR模型为平面三角形,故答案为:平面三角形;
=3,二氧化硫分子的VSEPR模型为平面三角形,故答案为:平面三角形;
(3) ①Al2Cl6加热时易升华,沸点较低,属于分子晶体,每个铝原子和四个氯原子形成共价键,采取sp3杂化,故答案为:分子;sp3;
②在[Al(OH)4]-中Al采取sp3杂化,用最外层的四个空轨道接受O提供的孤对电子形成配合物,其结构式为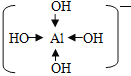 ,其中存在的化学键有极性共价键、配位键,故答案为:极性共价键、配位键;
,其中存在的化学键有极性共价键、配位键,故答案为:极性共价键、配位键;
⑷Al3+比Mg2+电荷多,半径小,使得氟化镁的晶格能小于氟化铝,故答案为:Al3+比Mg2+电荷多,半径小;
(5)①根据晶胞结构图,每个晶胞含有S原子4个,Zn原子个数=8×![]() +6×
+6×![]() =4,化学式为ZnS。在该晶胞中,硫原子位于4个Zn原子形成的正四面体的中心,每个S原子周围有4个Zn原子,则每个Zn原子周围也有4个S原子,配位数为4,故答案为:4;
=4,化学式为ZnS。在该晶胞中,硫原子位于4个Zn原子形成的正四面体的中心,每个S原子周围有4个Zn原子,则每个Zn原子周围也有4个S原子,配位数为4,故答案为:4;
②根据晶胞结构图,原子的坐标参数为a为(0,0,0);b(1/2,0,1/2),b为最后边面的面心;c为(1/2,1/2,0),c为最下边面的面心,d为最右边面的面心,则d原子的坐标参数为(1, ![]() ,
, ![]() ),故答案为:(1,
),故答案为:(1, ![]() ,
, ![]() );
);
③根据晶胞结构图,每个晶胞含有S原子4个,Zn原子个数=8×![]() +6×
+6×![]() =4,化学式为ZnS。1mol晶胞的质量为4×97g,设晶胞的边长为x,则x3×NA×ρg/cm3=4×97g,x=
=4,化学式为ZnS。1mol晶胞的质量为4×97g,设晶胞的边长为x,则x3×NA×ρg/cm3=4×97g,x=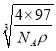 cm,两个S原子之间的距离等于两个Zn原子之间的距离等于面对角线的
cm,两个S原子之间的距离等于两个Zn原子之间的距离等于面对角线的![]() ,则两个S原子之间的距离为
,则两个S原子之间的距离为![]() ×
×![]() ×
×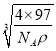 cm=
cm=![]() ×
×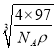 ×1010pm,故答案为:
×1010pm,故答案为: ![]() ×
×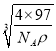 ×1010。
×1010。

【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) ![]() CO2(g)+H2(g), 某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g), 某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
容器 编号 | 温度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||
CO | H2O | CO2 | H2 | ||||
① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4kJ |
② | 650 | 2 | 4 | t1 | Q1 kJ | ||
③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 kJ |
(1)容器③中反应达平衡时,CO的转化率为_____________。
(2)容器①中反应达平衡这段时间,化学反应速率v (H2) =_______________。
(3)下列叙述正确的是 _____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1 > 32.8 kJ c.达到平衡的时间:t2 > t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
(4)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式______________________________________________;