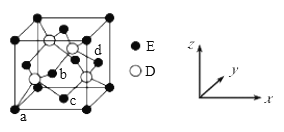
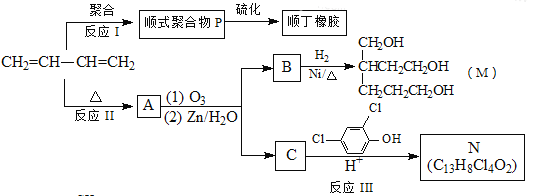
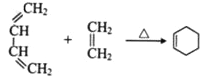
题目内容
【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g) ![]() CO2(g)+H2(g), 某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
CO2(g)+H2(g), 某研究小组分别在体积均为2L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
容器 编号 | 温度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||
CO | H2O | CO2 | H2 | ||||
① | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4kJ |
② | 650 | 2 | 4 | t1 | Q1 kJ | ||
③ | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 kJ |
(1)容器③中反应达平衡时,CO的转化率为_____________。
(2)容器①中反应达平衡这段时间,化学反应速率v (H2) =_______________。
(3)下列叙述正确的是 _____________(填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1 > 32.8 kJ c.达到平衡的时间:t2 > t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
(4)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式______________________________________________;
【答案】 80% 0.04mol/(L·min) a O2+2CO2+4e-=2CO32-
【解析】(1)容器③中反应达平衡时生成氢气是1.6mol,根据方程式可知消耗CO是1.6mol,所以CO的转化率为1.6/2×100%=80%。(2)容器①中反应达平衡这段时间生成氢气是0.4mol,浓度是0.4mol÷2L=0.2mol/L,所以化学反应速率v (H2) =0.2mol/L÷5min=0.04mol/(L·min)。(3)a.正反应体积不变,容器①和容器②中温度、容积相同,起始量之比相同,因此是等效平衡,则平衡时,容器①和容器②中CO2的体积分数相等,a正确;b.容器①和容器②中平衡等效,则②中平衡时生成氢气是0.8mol,所以反应达平衡状态时,Q2 >Q1=32.8 kJ,b错误;c.温度高,浓度大,反应速率快,则达到平衡的时间:t2<t1<5 min,c错误;d.根据以上分析可知升高温度平衡向正反应方向进行,正反应是吸热反应,该反应的热化学方程式可表示为:CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H=+41 kJ/mol,d错误,答案选a;(4)原电池中正极发生得到电子的还原反应,因此空气在正极通入,由于是以熔融态的K2CO3为电解质,因此该燃料电池正极的电极反应式为O2+2CO2+4e-=2CO32-。
CO2(g)+H2(g) △H=+41 kJ/mol,d错误,答案选a;(4)原电池中正极发生得到电子的还原反应,因此空气在正极通入,由于是以熔融态的K2CO3为电解质,因此该燃料电池正极的电极反应式为O2+2CO2+4e-=2CO32-。

 巧学巧练系列答案
巧学巧练系列答案