��Ŀ����
����Ŀ��I��������X��������Ԫ�أ���������Ϊ�ǽ���Ԫ�أ���ԭ�Ӹ�����Ϊ1:1��X������ˮ��������ǿ�ᡣij�о�С��Ϊ̽������ɺ����ʣ���Ʋ����������ʵ�顣
��1��X�Ļ�ѧʽ��____________________��
��2��д�������ɫ��Һ�н��������ӵ�ʵ�������__________��
��3����ɫ��Һ�м���ͭƬ��ͭƬ���汻��ʴ�����Ӧ�����ӷ���ʽ�ǣ�_____________________��
II����֪��ɫ�����в������ʡ�Ϊ��һ��̽������ɣ��о�С�齫�������ù���ȫ������ϡ���ᣬ���100mL��Һ��ÿ��ȡ20.00mL����Һ����ƿ�У���2.000��10-2molL-1 KMnO4����Һ���еζ�������¼ʵ��Ľ�����±���
��� | 1 | 2 | 3 | 4 |
V����mL�� | 20.00 | 20.02 | 19.99 | 19.99 |
��4������жϵζ��յ㣺__________________��
��5������Һ��c(Fe2+) = ____________________��
��6���ú�ɫ����Ļ�ѧʽ��FexOy��ʽ�ɱ�ʾΪ_______________��
���𰸡�FeOCl ȡ������ɫ��Һ���ڽྻ�Թ��У��μӼ���KSCN��Һ������Һ��Ѫ��ɫ����˵����Fe3+ 2Fe3+ + Cu = 2Fe2+ + Cu2+ �����һ�α�KMnO4��Һ������ƿʱ����Һǡ�ñ�dz�ϣ��죩ɫ���Ұ�����ڲ���ɫ 0.1000mol.L-1 Fe4O5
��������
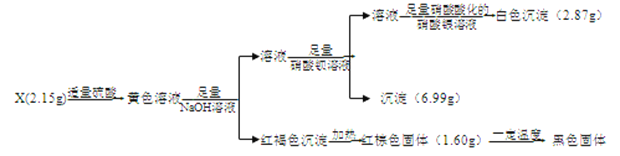
I��������������Ϣ��֪��2.15gX���������ᷴӦ�õ���ɫ��ҺΪ���������Ӽ���������ӵȵ���Һ����ɫ��Һ����������������Һ�������ɺ��ɫ�����������������������������Ⱥ����ɺ���ɫ����1.60g����������![]() =0.01mol����X�к���0.02 molFe3+������Ϊ0.02 mol
=0.01mol����X�к���0.02 molFe3+������Ϊ0.02 mol![]() =1.12g������������������Һ��Ӧ����Һ�����������ᱵ��Һ��Ӧ�������ᱵ����6.99g����Ϊ
=1.12g������������������Һ��Ӧ����Һ�����������ᱵ��Һ��Ӧ�������ᱵ����6.99g����Ϊ![]() =0.03mol��������������������������ᣬ��Ӧ������Һ���������������ữ����������Һ��Ӧ�õ���ɫ�����Ȼ���2.87g����Ϊ
=0.03mol��������������������������ᣬ��Ӧ������Һ���������������ữ����������Һ��Ӧ�õ���ɫ�����Ȼ���2.87g����Ϊ![]() =0.02mol���ʿ���֪X�к���0.02molCl-������Ϊ0.02 mol
=0.02mol���ʿ���֪X�к���0.02molCl-������Ϊ0.02 mol![]() =0.71g��������X��������Ԫ�أ���������Ϊ�ǽ���Ԫ�أ���ԭ�Ӹ�����Ϊ1:1������һ�ǽ���Ԫ��ҲΪ0.02 mol��������Ϊ2.15g-1.12g-0.71g=0.32g����Ħ������Ϊ
=0.71g��������X��������Ԫ�أ���������Ϊ�ǽ���Ԫ�أ���ԭ�Ӹ�����Ϊ1:1������һ�ǽ���Ԫ��ҲΪ0.02 mol��������Ϊ2.15g-1.12g-0.71g=0.32g����Ħ������Ϊ![]() =16g/mol��ӦΪOԪ�أ���XΪFeOCl��
=16g/mol��ӦΪOԪ�أ���XΪFeOCl��
��1��X�Ļ�ѧʽ��FeOCl��
��2�������ɫ��Һ�н���������Fe3+��ʵ�����Ϊ��ȡ������ɫ��Һ���ڽྻ�Թ��У��μӼ���KSCN��Һ������Һ��Ѫ��ɫ����˵����Fe3+��
��3����ɫ��Һ�м���ͭƬ��ͭƬ���汻��ʴ����Ӧ����Fe2+��Cu2+����Ӧ�����ӷ���ʽ�ǣ�2Fe3+ + Cu= 2Fe2+ + Cu2+��
II����4����ɫ�������������������Һ�к����������ӣ������Ը��������Һʹ����ɫ�����жϵζ��յ�Ϊ�������һ�α�KMnO4��Һ������ƿʱ����Һǡ�ñ�dz�ϣ��죩ɫ���Ұ�����ڲ���ɫ��
��5�����ݱ������ݿ�֪���ζ����ĵı�Һ��ƽ�����Ϊ20.00mL�����ݷ�Ӧ5Fe2+ + MnO4-+ 8H+=5Fe3+ + Mn2+ +4H2O��֪������Һ��c(Fe2+) =![]() ��
��
��6����ɫ�����к��е�Fe2+���ʵ���Ϊ![]() ,���������ʵ���Ϊ0.02 mol����n(Fe2+) : n(Fe3+) =0.01 mol: 0.01 mol=1:1���ú�ɫ����Ļ�ѧʽ��FexOy��ʽ��ʾ�����ݻ������Ԫ�ػ��ϼ۴�����Ϊ0������
,���������ʵ���Ϊ0.02 mol����n(Fe2+) : n(Fe3+) =0.01 mol: 0.01 mol=1:1���ú�ɫ����Ļ�ѧʽ��FexOy��ʽ��ʾ�����ݻ������Ԫ�ػ��ϼ۴�����Ϊ0������![]() ����x:y=4:5��FexOy�ɱ�ʾΪFe4O5��
����x:y=4:5��FexOy�ɱ�ʾΪFe4O5��