题目内容
)【化学—选修化学与技术】
工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时
可以得到硫酸钾肥料和氯化钙水合物储热材料。以下是有关的工艺流程示意图。
试回答:
(1)写出方程式:反应Ⅰ___________________________________,
(2)写出方程式:反应Ⅱ______________________________________。
(3)请根据下表和化学平衡知识,分析工业上制硫酸中SO2的催化氧化的适宜条件是
____________________________________。
表Ⅰ:
 压 强 / M Pa 压 强 / M Pa转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
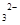 的方法是___________________________________。
的方法是___________________________________。(5)氯化钙结晶水合物(
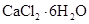 )是目前常用的无机储热材料,选择的依据是___________ (填序号)。
)是目前常用的无机储热材料,选择的依据是___________ (填序号)。a.熔点较低(29℃熔化) b.能导电 c.易溶于水 d.无毒
(15分)(1)2 (3分)
(3分)
(2) (3分)(反应不写水不扣分)
(3分)(反应不写水不扣分)
(3)常压、400—500℃、催化剂的条件下(3分)
(4)取少许滤液滴加到盐酸中产生气泡(3分) (5)a d (3分).
解析试题分析:(1)根据转化图可知,A应该是SO2,D是氧化钙,E和F是CO2和水,所以焦炭在高温下和石膏反应的方程式应该是2 。
。
(2)石膏和碳酸铵反应生成碳酸钙和硫酸铵,则反应的化学方程式是 。
。
(3)根据表中数据可知,在常压下,SO2的转化率已经很高,增大压强,对设备的越高,生产成本上升,所以采用的压强是常压。又因为催化剂的催化能力需要在一定温度下,所以实际采用的生产条件是常压、400—500℃、催化剂的条件下。
(4)碳酸盐能和盐酸反应产生气泡,据此可以检验碳酸盐,即检验滤液H中含有CO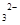 的方法是取少许滤液滴加到盐酸中产生气泡。
的方法是取少许滤液滴加到盐酸中产生气泡。
(5)氯化钙晶体是不能导电的,b不正确。溶于水显然不是选择的理由,所以答案选ad。
考点:考查方程式的书写、工业生成三氧化硫条件的选择
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,侧重对学生能力的培养和解题方法的指导,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。

下图是某工厂对海水资源进行综合利用的示意图.
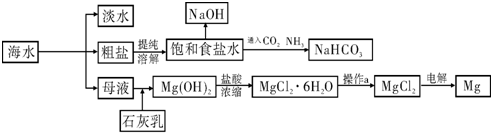
请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O