题目内容
【化学--选修化学与技术】
在工厂中常使用煤作燃料,但煤燃烧后会产生有害的SO2,按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)向大气中过量排放SO2将会形成酸雨污染.正常雨水的pH约为
(2)三氧化硫通入浓氨水,可得到一种肥料,写出反应的化学的方程式:
(3)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
(4)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法:
第一步是用Na2SO3水溶液吸收SO2;
第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2水蒸气副产品,写出上述两步反应的化学方程式:
①
②
在工厂中常使用煤作燃料,但煤燃烧后会产生有害的SO2,按“循环经济”的模式,就是要将SO2收集起来,把它变为有用的东西.
(1)向大气中过量排放SO2将会形成酸雨污染.正常雨水的pH约为
5.6
5.6
.(2)三氧化硫通入浓氨水,可得到一种肥料,写出反应的化学的方程式:
SO3+2NH3?H2O=(NH4)2SO4+H2O
SO3+2NH3?H2O=(NH4)2SO4+H2O
(3)某空气监测是根据SO2和溴水的定量反应来测定SO2的含量.该反应的化学方程式为
SO2+Br2+2H2O=2H2SO4+2HBr
SO2+Br2+2H2O=2H2SO4+2HBr
.反应后溶液的pH变小
变小
(填“变大”、“变小”或“不变”).若每次取样的空气为200mL,通入足量的溴水中,测得平均有2.408×1018个电子转移,则SO2的含量为0.64
0.64
mg?L-1,若规定空气中SO2含量不得超过0.02mg?L-1,则样气是否符合大气的质量标准不符合
不符合
(填“符合”或“不符合”).(4)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法:
第一步是用Na2SO3水溶液吸收SO2;
第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2水蒸气副产品,写出上述两步反应的化学方程式:
①
Na2SO3+SO2+H2O=2NaHSO3
Na2SO3+SO2+H2O=2NaHSO3
.②
2NaHSO3
Na2SO3+SO2↑+H2O
| ||
2NaHSO3
Na2SO3+SO2↑+H2O
.
| ||
分析:(1)正常雨水中溶解CO2,pH约为5.6;
(2)三氧化硫与酸性氧化物,与氨水反应生成硫酸铵;
(3)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应,根据方程式判断溶液PH变化以及相关计算;
(4)根据Na2SO3和NaHSO3的性质分析.
(2)三氧化硫与酸性氧化物,与氨水反应生成硫酸铵;
(3)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应,根据方程式判断溶液PH变化以及相关计算;
(4)根据Na2SO3和NaHSO3的性质分析.
解答:解:(1)正常雨水中溶解CO2,pH约为5.6,而当溶解SO2时,PH<5.6,故答案为:5.6;
(2)三氧化硫与酸性氧化物,与氨水反应生成硫酸铵,反应方程式为SO3+2NH3?H2O=(NH4)2SO4+H2O,
故答案为:SO3+2NH3?H2O=(NH4)2SO4+H2O;
(3)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应,反应方程式为SO2+Br2+2H2O=2H2SO4+2HBr,生成HBr和H2SO4,溶液酸性变强,PH变小,
n(e-)=
mol=4×10-6mol,则n(SO2)=2×10-6mol,m(SO2)=2×10-6mol×64g/mol=1.28×10-4g,
SO2的含量为:
=0.64mg/L,不符合大气的质量标准.
故答案为:SO2+Br2+2H2O=2H2SO4+2HBr;变小; 0.64;不符合;
(4)Na2SO3水溶液吸收SO2生成NaHSO3,反应的方程式为Na2SO3+SO2+H2O=2NaHSO3,NaHSO3不稳定,受热分解,反应的方程式为2NaHSO3
Na2SO3+SO2↑+H2O,
故答案为:Na2SO3+SO2+H2O=2NaHSO3;2NaHSO3
Na2SO3+SO2↑+H2O.
(2)三氧化硫与酸性氧化物,与氨水反应生成硫酸铵,反应方程式为SO3+2NH3?H2O=(NH4)2SO4+H2O,
故答案为:SO3+2NH3?H2O=(NH4)2SO4+H2O;
(3)SO2具有还原性,Br2具有氧化性,二者发生氧化还原反应,反应方程式为SO2+Br2+2H2O=2H2SO4+2HBr,生成HBr和H2SO4,溶液酸性变强,PH变小,
n(e-)=
| 2.408×1018 |
| 6.02×1023 |
SO2的含量为:
| 1.28×10-1mg |
| 0.2L |
故答案为:SO2+Br2+2H2O=2H2SO4+2HBr;变小; 0.64;不符合;
(4)Na2SO3水溶液吸收SO2生成NaHSO3,反应的方程式为Na2SO3+SO2+H2O=2NaHSO3,NaHSO3不稳定,受热分解,反应的方程式为2NaHSO3
| ||
故答案为:Na2SO3+SO2+H2O=2NaHSO3;2NaHSO3
| ||
点评:本题考查二氧化硫的性质,题目难度中等,注意相关基础知识的积累.

练习册系列答案
相关题目
【化学--选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
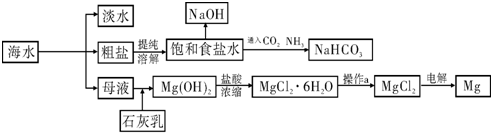
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 .
下图是某工厂对海水资源进行综合利用的示意图.

请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O