题目内容
(2012?唐山二模)【化学-选修化学与技术】
某科研小组设计出利用工业废酸(10% H2SO4)来堆浸某废弃的氧化铜锌矿的方案实现废物综合利用,方案如图所示.

已知各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)焙烧Zn2(OH)2CO3的化学反应方程式是
(2)堆浸后加入Fe粉发生的反应的离子方程式有
(3)加入A物质的目的是
A.KMnO4 B. HNO3 C.H2O2 D.Cl2
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在
(5)物质B可直接用作氮肥,则B的化学式是
某科研小组设计出利用工业废酸(10% H2SO4)来堆浸某废弃的氧化铜锌矿的方案实现废物综合利用,方案如图所示.

已知各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)焙烧Zn2(OH)2CO3的化学反应方程式是
Zn2(OH)2CO3
2ZnO+H2O+CO2↑
| ||
Zn2(OH)2CO3
2ZnO+H2O+CO2↑
.
| ||
(2)堆浸后加入Fe粉发生的反应的离子方程式有
Fe+2H+═Fe2++H2↑,Fe+Cu2+═Fe2++Cu
Fe+2H+═Fe2++H2↑,Fe+Cu2+═Fe2++Cu
.(3)加入A物质的目的是
将Fe2+氧化成Fe3+,以便除去
将Fe2+氧化成Fe3+,以便除去
,下列物质作为物质A使用较好的是C
C
.(填字母)A.KMnO4 B. HNO3 C.H2O2 D.Cl2
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在
3.2~6.2
3.2~6.2
范围之间.(5)物质B可直接用作氮肥,则B的化学式是
(NH4)2SO4
(NH4)2SO4
.分析:(1)Zn2(OH)2CO3在高温条件下分解生成氧化锌、二氧化碳和水;
(2)堆浸后溶液中有铜离子和氢离子,加入铁粉后与铜离子和氢离子;
(3)三价铁离子容易除去,所以要把二价铁离子转化为三价铁离子,考虑除杂过程不引入新的杂质;
(4)pH的范围应是使铁沉淀完全而锌不沉淀;
(5)结合题给信息利用工业废酸和氮肥考虑.
(2)堆浸后溶液中有铜离子和氢离子,加入铁粉后与铜离子和氢离子;
(3)三价铁离子容易除去,所以要把二价铁离子转化为三价铁离子,考虑除杂过程不引入新的杂质;
(4)pH的范围应是使铁沉淀完全而锌不沉淀;
(5)结合题给信息利用工业废酸和氮肥考虑.
解答:解:(1)Zn2(OH)2CO3在高温条件下分解生成氧化锌、二氧化碳和水,其反应方程式为:Zn2(OH)2CO3
2ZnO+H2O+CO2↑,
故答案为:Zn2(OH)2CO3
2ZnO+H2O+CO2↑;
(2)堆浸后溶液中有铜离子和氢离子,加入铁粉后与铜离子和氢离子,其离子方程式为:Fe+2H+═Fe2++H2↑ Fe+Cu2+═Fe2++Cu,
故答案为:Fe+2H+═Fe2++H2↑ Fe+Cu2+═Fe2++Cu;
(3)根据表中数据可知三价铁离子容易除去,所以要将Fe2+氧化成Fe3+,以便除去,选用,除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选C,
故答案为:将Fe2+氧化成Fe3+,以便除去;C;
(4)从图表数据可知,铁离子沉淀完全的pH为3.2,锌离子开始沉淀的PH为6.2.故除铁pH范围为:3.2~6.2,
故答案为:3.2~6.2;
(5)因所用废酸为硫酸,B又可作氮肥,所以B为(NH4)2SO4,
故答案为:(NH4)2SO4.
| ||
故答案为:Zn2(OH)2CO3
| ||
(2)堆浸后溶液中有铜离子和氢离子,加入铁粉后与铜离子和氢离子,其离子方程式为:Fe+2H+═Fe2++H2↑ Fe+Cu2+═Fe2++Cu,
故答案为:Fe+2H+═Fe2++H2↑ Fe+Cu2+═Fe2++Cu;
(3)根据表中数据可知三价铁离子容易除去,所以要将Fe2+氧化成Fe3+,以便除去,选用,除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选C,
故答案为:将Fe2+氧化成Fe3+,以便除去;C;
(4)从图表数据可知,铁离子沉淀完全的pH为3.2,锌离子开始沉淀的PH为6.2.故除铁pH范围为:3.2~6.2,
故答案为:3.2~6.2;
(5)因所用废酸为硫酸,B又可作氮肥,所以B为(NH4)2SO4,
故答案为:(NH4)2SO4.
点评:本题属于工艺流程图方面题目,要搞清实验目的和题给信息,结合流程和题目设问正确解题,本题难度中等.

练习册系列答案
相关题目
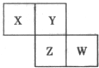 (2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
(2012?唐山二模)X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )