题目内容
【化学-选修 化学与技术】
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔.
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是 .
(2)为了充分利用反应放出的热量,接触室中应安装 (填设备名称);吸引塔中填充许多瓷管,其作用是 .
(3)吸收塔排放的尾气中含有少量的SO2,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用.
传统的方法是:尾气中的SO2通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式: ,其优点是 .
创新方法是:将尾气中的SO2用Na2SO3溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式: ,创新方法与传统方法相比,其优点是 .
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是 (填序号)
A.从沸腾炉出来的炉气需净化,因为炉气中的SO2与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO2的转化率
C.SO2被氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.SO3用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO3吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气 m3( O2空气中的体积分数按20%计算).
工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔.
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是
(2)为了充分利用反应放出的热量,接触室中应安装
(3)吸收塔排放的尾气中含有少量的SO2,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用.
传统的方法是:尾气中的SO2通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
创新方法是:将尾气中的SO2用Na2SO3溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是
A.从沸腾炉出来的炉气需净化,因为炉气中的SO2与杂质反应
B.硫酸生产中常采用高压条件,目的是提高SO2的转化率
C.SO2被氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.SO3用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO3吸收完全
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气
分析:(1)粉碎可增大反应物的接触面积,提高反应速率;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面;
(3)①SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];
②SO2用Na2SO3溶液吸收,然后再加热所得溶液,发生SO2+Na2SO3+H2O=2NaHSO3、2NaHSO3
SO2↑+Na2SO3+H2O;
(4)A.炉气需净化,防止催化剂中毒;
B.硫酸生产中常采用常压,高压下对设备的要求较高;
C.催化剂不能提高转化率;
D.SO3用98.3%浓硫酸吸收效果好;
(5)由S+O2
SO2、2SO2+O2
2SO3消耗氧气,根据O原子守恒可知2n(O2)=3n(SO3),根据S原子守恒可知n(SO3)=n(S),以此计算.
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面;
(3)①SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];
②SO2用Na2SO3溶液吸收,然后再加热所得溶液,发生SO2+Na2SO3+H2O=2NaHSO3、2NaHSO3
| ||
(4)A.炉气需净化,防止催化剂中毒;
B.硫酸生产中常采用常压,高压下对设备的要求较高;
C.催化剂不能提高转化率;
D.SO3用98.3%浓硫酸吸收效果好;
(5)由S+O2
| ||
| ||
| △ |
解答:解:(1)粉碎可增大与氧气的接触面积,使燃烧速率加快且更充分,提高原料的利用率,
故答案为:增大与氧气的接触面积,使燃烧速率加快且更充分,提高原料的利用率;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(3)①SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O],优点为生成的(NH4)2SO4作化肥,二氧化硫可循环利用,
故答案为:SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];生成的(NH4)2SO4作化肥,二氧化硫可循环利用;
②SO2用Na2SO3溶液吸收,然后再加热所得溶液,发生SO2+Na2SO3+H2O=2NaHSO3、2NaHSO3
SO2↑+Na2SO3+H2O,其优点为Na2SO3可循环利用,
故答案为:SO2+Na2SO3+H2O=2NaHSO3、2NaHSO3
SO2↑+Na2SO3+H2O;Na2SO3可循环利用;
(4)A.炉气需净化,是为防止催化剂中毒,故A错误;
B.硫酸生产中常采用常压,高压下对设备的要求较高,且常压下转化率较高,故B错误;
C.催化剂不能提高转化率,可加快反应速率,故C错误;
D.SO3用98.3%浓硫酸吸收效果好,可防止形成酸雾,有利于SO3吸收完全,故D正确;
故答案为:D;
(5)由S+O2
SO2、2SO2+O2
2SO3消耗氧气,根据O原子守恒可知2n(O2)=3n(SO3),根据S原子守恒可知n(SO3)=n(S)=n(H2SO4),
S的物质的量为
=8×104mol,故消耗氧气n(O2)=
n(SO3)=
×8×104mol=1.2×105mol,故消耗空气体积为5×1.2×105mol×22.4L/mol=134.4×105L=13440m3,
故答案为:13440.
故答案为:增大与氧气的接触面积,使燃烧速率加快且更充分,提高原料的利用率;
(2)充分利用能量,应安装热交换器,吸引塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收;
(3)①SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O],优点为生成的(NH4)2SO4作化肥,二氧化硫可循环利用,
故答案为:SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];生成的(NH4)2SO4作化肥,二氧化硫可循环利用;
②SO2用Na2SO3溶液吸收,然后再加热所得溶液,发生SO2+Na2SO3+H2O=2NaHSO3、2NaHSO3
| ||
故答案为:SO2+Na2SO3+H2O=2NaHSO3、2NaHSO3
| ||
(4)A.炉气需净化,是为防止催化剂中毒,故A错误;
B.硫酸生产中常采用常压,高压下对设备的要求较高,且常压下转化率较高,故B错误;
C.催化剂不能提高转化率,可加快反应速率,故C错误;
D.SO3用98.3%浓硫酸吸收效果好,可防止形成酸雾,有利于SO3吸收完全,故D正确;
故答案为:D;
(5)由S+O2
| ||
| ||
| △ |
S的物质的量为
| 8×106×98%g |
| 98g/mol |
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:13440.
点评:本题考查浓硫酸的性质及制备,把握制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,侧重化学与技术及工业生产的考查,题目难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
【化学--选修化学与技术】
下图是某工厂对海水资源进行综合利用的示意图.
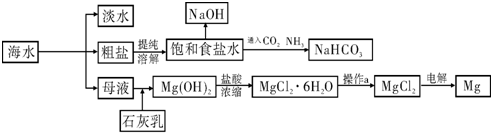
请回答下列问题:
(1)请列举一种海水淡化的方法 .;
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是 ,NaOH在电解槽的 室生成,由饱和食盐水制取NaOH的化学方程式为 ;
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是 .再由NaHCO3制得纯碱,化学方程式为 .
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
结合表中数据和实际生产情况说明,工业上生产镁采用电解MgCl2而不是电解MgO的理由 .
下图是某工厂对海水资源进行综合利用的示意图.

请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O