题目内容
(15分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)C在周期表中位于第 周期第 族,E基态原子核外电子排布式是
(2)A、B、D三种元素电负性由大到小排列顺序为 ,其中A的最高价氯化物构成晶体的微粒间作用力为
(3)A和B的最简单氢化物中较稳定的是 (填化学式)。B的最简单氢化物和E的黑色氧化物固体在加热时可反应,写出其反应方程式
(4)E的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出正极反应方程式
(5)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
① AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
② 2BO2(g) ?B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | Z的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为 ,其中A的最高价氯化物构成晶体的微粒间作用力为
(3)A和B的最简单氢化物中较稳定的是 (填化学式)。B的最简单氢化物和E的黑色氧化物固体在加热时可反应,写出其反应方程式
(4)E的单质和过氧化氢在稀硫酸中可反应,有人将这个反应设计成原电池,请写出正极反应方程式
(5)煤燃烧产生的烟气中有B的氧化物,会引起严重的环境问题,因此,常用AH4催化还原以消除污染,已知:
① AH4(g)+2 BO2(g)= B2(g)+AO2(g)+2H2O (g) △H1=-867kJ/mol
② 2BO2(g) ?B2O4(g) △H2=-56.9 kJ/mol
写出AH4和B2O4反应的热化学方程式
(1)三ⅠA,[Ar]3d104s1;(2)N>C>Si,分子间作用力(范德华力);
(3)NH3 2NH3+3CuO 3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;
3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;
(5)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol
(3)NH3 2NH3+3CuO
 3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;
3Cu+N2+3H2O;(4)H2O2+2e-+2H+=2H2O;(5)CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol
试题分析:根据题意可得:A是C;B是N;C是Na;D是Si;E是Cu。(1)Na在周期表中位于第三周期第ⅠA族;29号元素Cu基态原子核外电子排布式是1s22s22p63s23p63d104s1或[Ar]3d104s1;(2)C、N、Si三种元素的非金属性N>C>Si,元素的非金属性越强,元素的电负性就越大。因此元素的电负性由大到小排列顺序为N>C>Si。其中C元素的最高价氯化物CCl4构成晶体的分子晶体,分子间的作用力是分子间作用力也叫范德华力。(3)元素的非金属性越强,其氢化物的稳定性就越强,元素的非金属性N>C。所以CH4和NH3中较稳定的是NH3。根据电子守恒及质量守恒定律可得NH3和CuO固体在加热时反应的方程式是2NH3+3CuO
 3Cu+N2+3H2O。(4)Cu单质和过氧化氢在稀硫酸中可反应,可将这个反应设计成原电池,正极反应方程式H2O2+2e-+2H+=2H2O;负极的电极反应式为Cu-2e-=Cu2+。(5) ①-②整理可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol。
3Cu+N2+3H2O。(4)Cu单质和过氧化氢在稀硫酸中可反应,可将这个反应设计成原电池,正极反应方程式H2O2+2e-+2H+=2H2O;负极的电极反应式为Cu-2e-=Cu2+。(5) ①-②整理可得:CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1KJ/mol。
练习册系列答案
相关题目

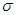 键与π键的数目之比为_________;
键与π键的数目之比为_________;

