题目内容
4.根据下表信息,判断以下叙述正确的是( )(部分短周期元素的原子半径及主要化合价)
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | M与T形成的化合物熔沸点高 | |
| B. | 最高价氧化物对应的水化物碱性:L<Q | |
| C. | 氢化物的还原性:H2 R<H2 T | |
| D. | 离子半径:T2-<L2+ |
分析 短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知R为S元素,L、M、Q只有正价,原子半径L>Q,则L为Mg元素,Q为Be元素,原子半径M的介于L、R之间,则M为Al元素.
A、M与T形成的化合物为氧化铝;
B、同主族从上到下金属性增强,其最高价氧化物对应的水化物碱性增强;
C、非金属性越强,氢化物的还原性越弱;
D、电子排布式相同的离子,原子序数越大,离子半径越小.
解答 解:短周期元素,由元素的化合价可知,T只有-2价,则T为O元素,可知R为S元素,L、M、Q只有正价,原子半径L>Q,则L为Mg元素,Q为Be元素,原子半径M的介于L、R之间,则M为Al元素.
A、M与T形成的化合物为氧化铝,氧化铝的熔沸点很高,故A正确;
B、同主族从上到下金属性增强,其最高价氧化物对应的水化物碱性增强,金属性:Be<Mg,则最高价氧化物对应的水化物碱性:L>Q,故B错误;
C、非金属性越强,氢化物的还原性越弱,非金属性:S<O,则氢化物的还原性:H2R>H2T,故C错误;
D、电子排布式相同的离子,原子序数越大,离子半径越小,则离子半径:T2->L2+,故D错误.
故选A.
点评 本题考查元素的性质,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.

练习册系列答案
相关题目
14.下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ).
根据上述数据回答题:
(1)下列物质本身具有的能量最高的是D (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?能(填能、否)你的根据是元素非金属性越强,形成的气态氢化物越稳定.
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量 | 243 | 193 | 151 | 436 | 568 | 432 | 366 | 298 |
(1)下列物质本身具有的能量最高的是D (填A.B.C.D)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是A (填A.B.C.D),若无上表中的数据,你能正确回答出此问题吗?能(填能、否)你的根据是元素非金属性越强,形成的气态氢化物越稳定.
A.HF B.HCl C.HBr D.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是放热反应(填“吸热”或“放热”)
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氯气(填写分子式).
15.一定质量铜和适量的浓硝酸反应,随着反应的进行,所生成的气体颜色逐渐变浅,当铜反应完毕后,共收集到11.2L气体(标况),将该气体与0.325molO2混合溶于水,恰好无气体剩余.则反应中消耗硝酸的物质的量( )
| A. | 1.2mol | B. | 1.1mol | C. | 1.8 mol | D. | 1.6mol |
9.分子式为C6H13Cl且分子结构中含三个甲基的有机物的同分异构体有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
14.如图是某条件时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
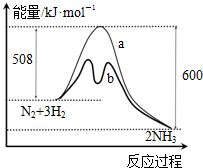

| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |
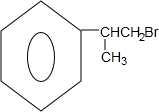
 根据所学知识回答下列问题,在如图所示装置中
根据所学知识回答下列问题,在如图所示装置中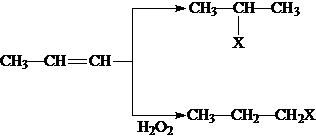 (X为溴原子)
(X为溴原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.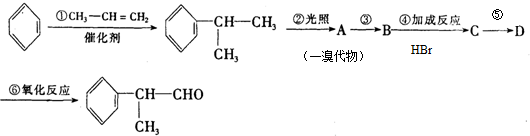
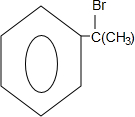
 .
. 、
、 、
、 任意1种.
任意1种.