题目内容
11.下列各图表示在含HCl、氯化铝(AlCl3)各0.1mol的溶液中,缓慢滴加氢氧化钠溶液,生成沉淀的物质的量与加入氢氧化钠的物质的量的关系,其中正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 在含HCl、氯化铝(AlCl3)各0.1mol的溶液中,缓慢滴加氢氧化钠溶液,首先HCl与NaOH反应,然后AlCl3与NaOH反应生成氢氧化铝沉淀,当NaOH过量时,氢氧化铝与NaOH反应生成偏铝酸钠,结合方程式中物质的物质的量的关系分析.
解答 解:在含HCl、氯化铝(AlCl3)各0.1mol的溶液中,缓慢滴加氢氧化钠溶液,首先HCl与NaOH反应,其反应为NaOH+HCl=NaCl+H2O,则加入的NaOH的物质的量为0到0.1mol时,没有沉淀生成;
然后AlCl3与NaOH反应生成氢氧化铝沉淀,反应为3NaOH+AlCl3=3NaCl+Al(OH)3↓,则加入的NaOH的物质的量为0.1到0.4mol时,有0.1mol沉淀生成;
当NaOH过量时,氢氧化铝与NaOH反应生成偏铝酸钠,NaOH+Al(OH)3=NaAlO2+2H2O,则加入的NaOH的物质的量为0.4到0.5mol时,沉淀完全消失;
则图象B符合;
故选B.
点评 本题以铝化合物为载体考查了混合物的计算,知道曲线拐点及变化趋势的含义是解本题关键,再结合方程式来分析解答,注意铝离子完全转化为沉淀和沉淀完全溶解需要氢氧化钠物质的量的关系,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)C、G两元素的最高价氧化物对应水化物相互反应的离子方程是:Al(OH)3+OH-=AlO2-+2H2O
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
(2)在一定条件下,A与E可形成化合物的化学式是NH3,其水溶液呈碱性(填“酸”、“碱”或“中”).
(3)写出A与F形成化合物的电子式
 ,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
,该化合物与C单质反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
2.下列关于元素周期表的说法正确的是( )
| A. | 在元素周期表中,每一列就是一个族 | |
| B. | 主族元素都是短周期元素 | |
| C. | 副族元素都是金属元素 | |
| D. | 元素周期表每个长周期包含32种元素 |
6.下列实验事实不能用平衡移动原理解释的是( )
| A. |  将NO2球浸泡在冷水中和热水中 | |
| B. | 排饱和食盐水收集氯气 | |
| C. | 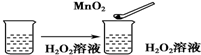 | |
| D. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3△H<0工业合成氨,通常选择高压的条件 |
3.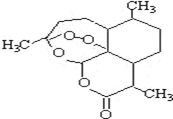 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H22O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 该化合物中含有过氧键,一定条件下有氧化性 | |
| D. | 青蒿素易溶于水 |
1.在低温下电解饱和KHSO4溶液可制备K2S2O8,电解装置如图所示.下列说法不正确的是( )

| A. | 阳极的电极反应式为2SO42--2e-═S2O82- | |
| B. | 电解的总反应方程式为2KHSO4$\frac{\underline{\;通电\;}}{\;}$K2S2O8+H2↑ | |
| C. | 一段时间后,溶液的pH减小 | |
| D. | 电解过程中,阳极产生微量能使湿润的淀粉KI试纸变蓝的有色单质气体,该气体可能是O3 |
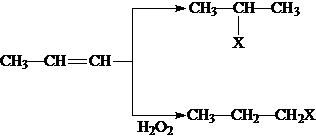 (X为溴原子)
(X为溴原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.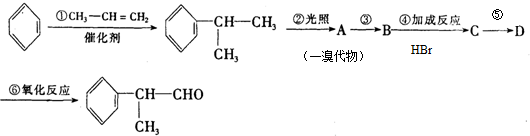
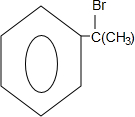
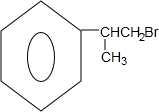 .
. 、
、 、
、 任意1种.
任意1种.