题目内容
17.请根据氧化还原反应Fe+2H+=Fe2++H2↑设计成原电池:(1)负极材料为:Fe发生的电极反应是:Fe-2e-═Fe2+,电流流出(填“流出”或“流入”)
(2)正极发生的电极反应是:2H++2e-═H2↑该反应为还原反应(填“氧化反应”或“还原反应”)
(3)若电路中转移6.02×1022个e-,则产生标况下H2的体积为1.12L.
分析 (1)(2)由方程式可知,Fe元素化合价由0价变为+2价,则负极应为Fe,发生氧化反应生成Fe2+,正极为活泼性比铁弱的金属或非金属,发生还原反应,H+被还原生成H2,则电解质溶液为稀盐酸或稀硫酸;
(3)根据氢气和转移电子之间的关系式计算氢气体积.
解答 解:(1)由方程式可知,Fe元素化合价由0价变为+2价,则负极应为Fe,发生氧化反应生成Fe2+,电极反应式为Fe-2e-═Fe2+,电子从负极沿导线流向正极,所以负极上电子流出,
故答案为:Fe;Fe-2e-═Fe2+;流出;
(2)正极上氢离子得电子发生还原反应,电极反应式为2H++2e-═H2↑,故答案为:2H++2e-═H2↑;还原反应;
(3)根据2H++2e-═H2↑知,生成22.4L氢气需要转移2×6.02×1023个e-,电子,则转移6.02×1022个e-生成氢气体积=$\frac{6.02×1{0}^{22}}{2×6.02×1{0}^{23}}×22.4L$=1.12L,
故答案为:1.12L.
点评 本题考查原电池设计,明确原电池原理是解本题关键,知道从化合价变化确定正负极、电解质溶液,题目难度不大.

练习册系列答案
相关题目
8.下列叙述中,正确的是( )
| A. | 植物油和裂化汽油都能使溴水褪色 | B. | 食用植物油是人体的营养物质 | ||
| C. | 汽油、煤油、卤代烃均为烃 | D. | 甲醛可大量用作食品防腐剂 |
9.下列事实中,能说明氯的非金属性比硫强的是( )
①HClO的氧化性比H2SO4的氧化性强;
②常温下氯气是气态而硫是固态;
③盐酸酸性比氢硫酸强;
④HCl比H2S稳定;
⑤H2S能被Cl2氧化成硫;
⑥HClO4酸性比H2SO4强;
⑦氯气与氢气化合比硫与氢气化合要容易进行;
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HClO的氧化性比H2SO4的氧化性强;
②常温下氯气是气态而硫是固态;
③盐酸酸性比氢硫酸强;
④HCl比H2S稳定;
⑤H2S能被Cl2氧化成硫;
⑥HClO4酸性比H2SO4强;
⑦氯气与氢气化合比硫与氢气化合要容易进行;
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①④⑤⑥⑦ | C. | ④⑤⑥⑦⑧ | D. | ③④⑤⑦⑧ |
6.下列含有非极性键的化合物是( )
| A. | MgCl2 | B. | Na2O2 | C. | H2O | D. | CH4 |

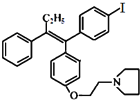 (不考虑立体结构).
(不考虑立体结构).
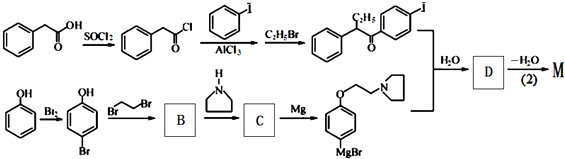


 D
D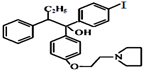
 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种. 中任一种.
中任一种. +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HBr.
+HBr. 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇 的合成路线
的合成路线 (不超过5步反应).
(不超过5步反应). (1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑.
(1)现有如下两个反应:①NaOH+HCl=NaCl+H2O,②Fe+H2SO4=FeSO4+H2↑. (填序号)
(填序号)