题目内容
(7分)在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:
(1)达到平衡后,反应器左室气体总的物质的量为 mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围 。
(3)若要使右室反应开始时V正<V逆,x的取值范围 。
(1)3.5mol (1分) (2)2.0<x<3.0 (3分) (3)1.5<x<2.0(3分)
解析试题分析:(1)方法一:在左室反应2M(g)+3N(s) 2P(g)中,开始时,M、N、P为2.5mol、3.0mol、1.0mol。达到平衡后,测得M的转化率为75%,则平衡时M:2.5mol×25%=0.625mol;P: 2.5mol×75%+1.0mol=2.875mol.所以气体的总物质的量是2.875mol+0.625mol=3.5mol。方法二:由于该反应是反应前后气体体积相等的反应,所以达到平衡时与反应开始时气体的物质的量相等,因此平衡时气体的物质的量是2.5mol+1.0mol=3.5mol。(2)若要使右室反应开始时V正>V逆,且隔板在反应器的正中位置x的取值范围是0.50mol×3+x>3.50mol;x>2mol;若反应是完全从正反应方向开始的,C、D的物质不是加入的,认为是反应消耗A、B生成的,则根据反应方程式中各种物质的物质的量的关系可知,会消耗B物质1mol,则B的最大物质的量是2+1=3mol,故若要使右室反应开始时V正>V逆,x的取值范围是2.0mol<x<3.0mol。(3)若要使右室反应开始时V正<V逆,即反应逆向进行,由于平衡时气体的物质的量是3.50mol, 0.50mol×3+x≤3.50mol;所以x最大值是2.0mol,若使反应逆向进行,反应是逆向开始的,则每反应消耗2mol的C和1mol的D,有1mol的A产生,4mol的B产生,就会现在产生0.50mol的A,则消耗C的物质的量是0.50mol,消耗D是0.250mol ,产生A 0.250mol,产生B1mol;还有D0.250mol则x+0.750mol+1mol+0.25=3.50mol,解得x=1.50mol。因此开始时B的物质的量是2mol-1mol=1mol,故相应的B的取值范围是1.5<x<2.0。
2P(g)中,开始时,M、N、P为2.5mol、3.0mol、1.0mol。达到平衡后,测得M的转化率为75%,则平衡时M:2.5mol×25%=0.625mol;P: 2.5mol×75%+1.0mol=2.875mol.所以气体的总物质的量是2.875mol+0.625mol=3.5mol。方法二:由于该反应是反应前后气体体积相等的反应,所以达到平衡时与反应开始时气体的物质的量相等,因此平衡时气体的物质的量是2.5mol+1.0mol=3.5mol。(2)若要使右室反应开始时V正>V逆,且隔板在反应器的正中位置x的取值范围是0.50mol×3+x>3.50mol;x>2mol;若反应是完全从正反应方向开始的,C、D的物质不是加入的,认为是反应消耗A、B生成的,则根据反应方程式中各种物质的物质的量的关系可知,会消耗B物质1mol,则B的最大物质的量是2+1=3mol,故若要使右室反应开始时V正>V逆,x的取值范围是2.0mol<x<3.0mol。(3)若要使右室反应开始时V正<V逆,即反应逆向进行,由于平衡时气体的物质的量是3.50mol, 0.50mol×3+x≤3.50mol;所以x最大值是2.0mol,若使反应逆向进行,反应是逆向开始的,则每反应消耗2mol的C和1mol的D,有1mol的A产生,4mol的B产生,就会现在产生0.50mol的A,则消耗C的物质的量是0.50mol,消耗D是0.250mol ,产生A 0.250mol,产生B1mol;还有D0.250mol则x+0.750mol+1mol+0.25=3.50mol,解得x=1.50mol。因此开始时B的物质的量是2mol-1mol=1mol,故相应的B的取值范围是1.5<x<2.0。
考点:考查物质的量对可逆反应平衡的影响的知识。

某反应中,X、Y、Z三种物质的物质的量随时间的变化如图所示。下列说法正确的是
| A.反应为 X + 2Z= Y |
B.反应为 X + Y 2Z 2Z |
| C.4 s 时,反应达到平衡 |
| D.12 s 时,反应不再进行 |
某可逆反应L(s) + G(g)  3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
3R(g) △H>0,下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示( )
| A.平衡混合气中R的质量分数 | B.达到平衡时G的转化率 |
| C.平衡混合气中G的质量分数 | D.达到平衡时L的转化率 |
(8分)(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 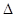 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
 2SO3(g)
2SO3(g) 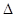 H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。 (10分) )氮元素有着多变价态和种类繁多的化合物,因在生产、生活中发挥着重要的作用。完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是________(填序号)。
A.2v(H2)正=3v(NH3)逆 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡常数_____。(填“增大”、“减小”或“不变”)
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)____ Ksp(AgBr) (填“>”、“=”或“<”)。
( 2 )肼是氮元素的另一种氢化物,分子式为N2H4。
①298 K时,1.00 g N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15 kJ的热量。写该反应的热化学方程式_____________________________________。
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式____________________。
2014年初雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。据此判断:
①该反应在 能自发进行(填“高温下” 、“低温下” 或“任何温度下”);
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
(2)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
在恒压下,将CH4(g)和NO2(g)置于密闭容器中,也可以发生化学反应:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
N2(g)+CO2(g)+2H2O(g) ΔH<0,提高NO2转化率的措施有
| A.增加原催化剂的表面积 | B.降低温度 |
| C.减小投料比[n(NO2) / n(CH4)] | D.增大压强 |

从图中可以得出的结论是
结论一:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
推测原因是
结论二:
(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H="-92.4" kJ/mol,该反应的能量变化如图所示。
H="-92.4" kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
2N2(g)+6H2O(1)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol又知:H2O(1)=H2O(g)
 H="+44.0" kJ/mol
H="+44.0" kJ/mol则2N2(g)+6H2O(g)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。 硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为______;生成SO3的化学反应速率为______。
(2)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
| A.压缩体积,增大压强 | B.降低温度 | C.充入大量的氮气 | D.仅增加SO2的浓度 |
 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答: 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动) 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)