题目内容
(11分)
(1)在一密闭的2 L的容器里充入8 mol SO2和4 mol18O2,在一定条件下开始反应:
2SO2(g)+O2(g) 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
①反应后18O原子存在于哪些物质中________
②2 min末SO3的浓度为________
③用O2的浓度变化表示该时间段内的化学反应速率为________
(2)基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
①可以用来鉴别苯蒸气和乙烯的试剂是________(填序号)
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液 D.氢气
②苯分子具有平面正六边形结构,所有原子共平面,则苯分子中在一条直线上的原子最多有________个
(3)下列营养物质在人体内发生的变化及其对人的生命活动所起的作用不正确的是
A.人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量
B.淀粉和纤维素 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 甘油和高级脂肪酸
甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 氨基酸
氨基酸 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
(11分)
(1)① SO2 O2 SO3 (1分)
② 0.4 mol/L (单位不写扣1分) (2分)
③ 0.1 mol/(L?min) (单位不写扣1分) (2分)
(2)① BC (2分)
② 4 (2分)
(3) B (2分)
解析试题分析:(1)①该反应为可逆反应,SO2中会有18O原子
②2 min末测得容器中有7.2 mol SO2,0.8 mol SO2转化成0.8 mol SO3,浓度为0.4 mol/L
③2 min 0.8 mol SO2转化成0.8 mol SO3,0.4 mol O2 转化,除以容器容积,除以时间,得到
0.1 mol/(L?min)
(2)①酸性高锰酸钾溶液 :使酸性高锰酸钾溶液褪色的是乙烯。分层后,油状物在上层的是苯,油状物在下层的是四氯化碳 ;溴水的四氯化碳溶液 :使溴水褪色的是乙烯。分层后,下层有色的是四氯化碳,上层有色的是苯。
考点:化学反应速率与化学平衡

2013年9月,中国华北华中地区发生了严重的雾霆天气,北京?河北?河南等地的空气污染升为6级空气污染,属于重度污染?汽车尾气?燃煤废气?冬季取暖排放的CO2等都是雾霆形成的原因?
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
①能判断该反应达到平衡状态的标志是 ?
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为:

①该反应在 下能自发进行(填“高温”或“低温”)?
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为 ?(已知:
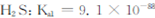 ;
; ?
? ;
;  ?)
?) (3)已知反应:
 ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
①实验1条件下平衡常数K= (保留小数点后二位)?
②实验3中,若平衡时,CO的转化率大于水蒸气,则a?b必须满足的关系是 ?
③该反应的
 0(填“<”或“>”);
0(填“<”或“>”); (5分)氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家。
(1)右图表示温度为T K时氮气与氢气合成氨反应过程中的能量变化, 写出该反应的热化学方程式 。
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行。得到如下数据:
| 时间(h) 物质的量(mol) | | 0 | 1 | 2 | 3 | 4 |
| N2 | | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①0~1h内N2的平均反应速率为mol/(L·h)。
②反应进行到2h时放出的热量为 kJ。
③此条件下,反应:N2 + 3H2
 2NH3的化学平衡常数K = (保留两位小数)。
2NH3的化学平衡常数K = (保留两位小数)。④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1mol,化学平衡移动的方向是 (填“正反应”或“逆反应”或“不移动”)。
.(16分)Ⅰ.已知下列反应的热化学方程式为:
(1) C(s) + O2(g) = CO2(g) △H1 =" -393.5" kJ/mol
(2) CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H2 =" -870.3" kJ/mol
(3) 2H2(g) + O2(g) = 2H2O(l) △H3 =" -571.6" kJ/mol
请计算:2C(s) + 2H2(g) + O2(g)= CH3COOH(l) △H4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2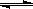 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
(1)向1L正庚烷中加入0.50mol(t-BuNO)2,10min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1L)。反应在前10min内的平均速率为ν(t-BuNO)= 。列式计算上述反应的平衡常数K = 。
(2)有关反应:(t-BuNO)2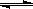 2(t-BuNO) 的叙述正确的是( )
2(t-BuNO) 的叙述正确的是( )
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。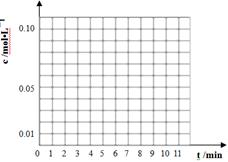
| 时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
| c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
| c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.07 | 0.094 | 0.096 | 0.096 |
 xC(g)△H<0,B、C的物质的量随时间变化的关系如下图(左),达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如下图(右)。下列有关说法正确的是( )
xC(g)△H<0,B、C的物质的量随时间变化的关系如下图(左),达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如下图(右)。下列有关说法正确的是( )


 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。