题目内容
(8分)(1)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g)
CO2(g) + 3H2(g) 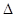 H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的 倍。
②该条件下的该反应的平衡常数是 (结果保留两位有效数字)。
③该条件下反应达平衡状态的依据是(填序号) 。
| A.v正(CH3OH)=v正(CO2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
 2SO3(g)
2SO3(g) 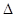 H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b _______ 1(填“﹤”、“﹥”或“=”) 。
⑴① 1.2 (2分) ② 0.11 mol2/L2(2分) ③ D (2分) ;⑵﹤(2分)。
解析试题分析:(1)①根据反应方程式可知:若有1mol的甲醇反应,会放出热量49.4 kJ,加入1 mol CH3OH(g)和3 mol H2O(g),反应放出热量是19.76 kJ,则发生反应的甲醇的物质的量是19.76÷49.4=0.4mol.则达到平衡是各种气体的物质的量是甲醇:0.6mol;H2O(g):2.6mol; CO2(g) :0.4mol, H2(g) :1.2mol.平衡混合气体的总物质的量是4.8mol。在恒容的密闭容器内。气体的物质的量的比等于它们的压强之比,因此 达平衡时混合气体的压强是反应前的4.8mol÷4mol=1.2倍。②该条件下的该反应的平衡常数K=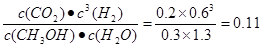 mol2/L2;③A.由于CH3OH和CO2一个是反应物,一个是生成物,二者的系数相同,所以在任何体积下,都存在v正(CH3OH)=v正(CO2),故不能作为判断该条件下反应达平衡状态的依据,错误;B.由于反应前后气体的质量不变,体积也不变,所以无论反应是否达到平衡,混合气体的密度都不变,故不能作为判断该条件下反应达平衡状态的依据,错误;C.由于加入的二者的物质的量的比是1:3,发生反应时消耗的物质的量的比是1:1,所以c(CH3OH)和 c(H2O)不可能相等,故不能作为判断该条件下反应达平衡状态的依据,错误;D.由于该反应是反应前后气体的物质的量不等,所以混合气体的总物质的量不变,说明反应达到平衡状态,故能作为判断该条件下反应达平衡状态的依据,正确。(2)假如反应是从正反应方向开始的,则两种情况的开始状态相同。甲、乙起始反应温度相同,若与外界有热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b=1,但是该体系都不与外界进行气体有热量交换,由于升高温度,平衡向吸热反应方向移动,所以平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系必小于有热量交换的情况,即a+b<1.
mol2/L2;③A.由于CH3OH和CO2一个是反应物,一个是生成物,二者的系数相同,所以在任何体积下,都存在v正(CH3OH)=v正(CO2),故不能作为判断该条件下反应达平衡状态的依据,错误;B.由于反应前后气体的质量不变,体积也不变,所以无论反应是否达到平衡,混合气体的密度都不变,故不能作为判断该条件下反应达平衡状态的依据,错误;C.由于加入的二者的物质的量的比是1:3,发生反应时消耗的物质的量的比是1:1,所以c(CH3OH)和 c(H2O)不可能相等,故不能作为判断该条件下反应达平衡状态的依据,错误;D.由于该反应是反应前后气体的物质的量不等,所以混合气体的总物质的量不变,说明反应达到平衡状态,故能作为判断该条件下反应达平衡状态的依据,正确。(2)假如反应是从正反应方向开始的,则两种情况的开始状态相同。甲、乙起始反应温度相同,若与外界有热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b=1,但是该体系都不与外界进行气体有热量交换,由于升高温度,平衡向吸热反应方向移动,所以平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系必小于有热量交换的情况,即a+b<1.
考点:考查外界条件对平衡的移动、物质的转化率的影响、平衡状态的判断、物质的转化率、平衡常数的计算的知识。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案下列说法正确的是
| A.一定条件下,增加反应物的量,必定加快反应速率 |
| B.升高温度正反应速率增大,则逆反应速率也一定增大 |
| C.可逆反应的特征是正反应速率总是和逆反应速率相等 |
| D.使用催化剂一定会加快反应速率 |
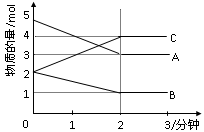
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
2Z(g);ΔH<0下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 
| A.t2时加入了催化剂 | B.t3时降低了温度 |
| C.t5时增大了压强 | D.t4~t5时间内转化率最低 |
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京?河北?河南等地的空气污染升为6级空气污染,属于重度污染?汽车尾气?燃煤废气?冬季取暖排放的CO2等都是雾霆形成的原因?
(1)汽车尾气净化的主要原理为; , 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
, 在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态?
①能判断该反应达到平衡状态的标志是 ?
| A.在单位时间内生成1molCO2的同时消耗了lmolCO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应为:

①该反应在 下能自发进行(填“高温”或“低温”)?
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为 ?(已知:
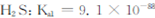 ;
; ?
? ;
;  ?)
?) (3)已知反应:
 ,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
,现将不同量的CO(g)和H20(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据: 
①实验1条件下平衡常数K= (保留小数点后二位)?
②实验3中,若平衡时,CO的转化率大于水蒸气,则a?b必须满足的关系是 ?
③该反应的
 0(填“<”或“>”);
0(填“<”或“>”);  2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )  2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
2SO3(g) 2min末测得容器中有7.2mol SO2。试回答:
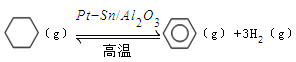 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。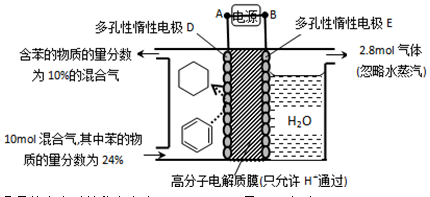
 =_____(
=_____( ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)