题目内容
18.下列说法正确的是( )| A. | 构成原电池正极和负极的材料必须是金属 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
分析 A、燃料电池中电极可以是石墨;
B、原电池中负极失电子被氧化;
C、形成原电池能加快反应速率;
D、原电池中化学能除转化为电能外,还有部分转化为热能.
解答 解:A、燃料电池中电极可以是石墨,原电池的正极材料也可以选用石墨电极,故A错误;
B、原电池中负极失电子被氧化,正极得电子被还原,故B错误;
C、粗锌与稀硫酸能形成原电池,能加快反应速率,所以实验室欲快速制取氢气,可利用粗锌与稀硫酸反应,故C正确;
D、原电池中化学能除转化为电能外,还有部分转化为热能,原电池的能量转化率小于100%,故D错误.
故选C.
点评 本题考查了原电池知识,题目难度不大,侧重于基础知识的考查,注意把握原电池中电极的判断.

练习册系列答案
相关题目
9.C2H6+Cl2$\stackrel{光照}{→}$C2H5Cl+HCl的反应类型为( )
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 消去反应 |
6.在温度t℃下,某Ba(OH)2的稀溶液中?c(H+)=10-amol.L-1,c(OH-)=10-b mol.L-1,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,t℃大于25℃(填”大于”“小于”或”等于”),该温度下水的离子积KW=1×10-12.
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(2)b=4,原Ba(OH)2的稀溶液的物质的量浓度为?5×10-5mol/L?.
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为4,以及其中Na2SO4的物质的量浓度为1×10-4mol/L.
13.同周期的X、Y、Z三种元素的最高价氧化物对应水化物分别是:H3XO4、H2YO4、HZO4,下列判断正确的是( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4.
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
⑤酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4.
| A. | ①② | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
3.下列关于苯酚的叙述中,正确的是( )
| A. | 苯酚能与FeCl3溶液反应生成紫色沉淀 | |
| B. | 苯酚呈弱酸性,能使紫色石蕊试液显浅红色 | |
| C. | 向少量苯酚溶液中滴加饱和溴水,可观察到白色沉淀 | |
| D. | 苯酚有强腐蚀性,沾在皮肤上可用水洗涤 |
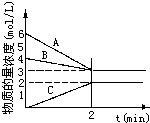 选择适宜的材料和试剂设计一个原电池,完成下列反应:
选择适宜的材料和试剂设计一个原电池,完成下列反应: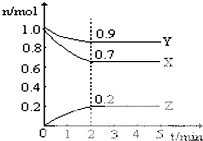 某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: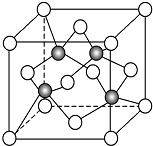 碳及其化合物与人类关系密切
碳及其化合物与人类关系密切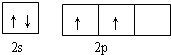 ,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.
,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.