题目内容
7.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.(1)A为C,B为O,C为Na.D的最高价氧化物的水化物是H2SO4.
(2)写出A、B的化合物与E反应的化学方程式:2CO2+2Na2O2═2Na2CO3+O2.
(3)A、B两元素形成化合物属共价(填“离子”或“共价”)化合物.
分析 A、B、C、D四种元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,可知E为过氧化钠,B元素为O元素,C元素为Na元素;A原子的最外层上有4个电子,处于ⅣA族,原子序数小于氧,故A为碳元素;D的L层电子数等于K、M两个电子层上的电子数之和,则M层电子数为8-2=6,故D为S元素,据此解答.
解答 解:A、B、C、D四种元素,原子序数依次增大,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,可知E为过氧化钠,B元素为O元素,C元素为Na元素;A原子的最外层上有4个电子,处于ⅣA族,原子序数小于氧,故A为碳元素;D的L层电子数等于K、M两个电子层上的电子数之和,则M层电子数为8-2=6,故D为S元素.
(1)由上述分析可知,A为C元素,B为O元素,C为Na.D为S元素,其最高价氧化物的水化物是H2SO4,
故答案为:C;O;Na;H2SO4;
(2)A元素为碳,B元素为氧,它们形成的化合物为二氧化碳能与E(即过氧化钠)反应,化学方程式为:2CO2+2Na2O2═2Na2CO3+O2,
故答案为:2CO2+2Na2O2═2Na2CO3+O2;
(3)A、B两元素形成化合物有CO、CO2,属于共价化合物,
故答案为:共价.
点评 本题考查位置结构性质的关系,题目难度不大,根据原子结构特点以及化合物的特征推断元素的种类为解答关键.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 构成原电池正极和负极的材料必须是金属 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
2.在冷暗条件下就能跟H2发生剧烈反应而爆炸的物质是( )
| A. | N2 | B. | F2 | C. | O2 | D. | C12 |
12.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | |
| B. | F-离子结构示意图: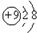 | |
| C. | 用电子式表示HCl形成过程:H${\;}_{\;}^{•}$+${\;}_{\;}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 次氯酸电子式:H${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
19.下列变化中,属于化学变化的是( )
| A. | 石油分馏 | |
| B. | 煤的干馏 | |
| C. | 苯中加入溴水 | |
| D. | 煤焦油中提取苯、甲苯、二甲苯等产物 |
16.下列叙述中,正确的是( )
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 | |
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 | |
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
17.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=a kJ•mol一1
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
 .
. $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$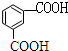
 ;
;