题目内容
2.化学反应常常涉及到气体,气体在千变万化的化学反应中充当着重要角色.完成下列计算:
(1)足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下1.68LO2混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5 mol•L-1NaoH溶液至Cu2+恰好完全沉淀,则所用氧气的物质的量为0.075mol,消耗NaOH溶液的体积是60mL.
某化工厂以甲就为原料中合成甲醇的反应为:
CH4(g)+H2O→CO(g)+3H2(g)…①(反应中CH4转化率为100%)
CO(g)+2H2(g)→CH3OH(g)…②(反应中CO有$\frac{2}{3}$转化)
合成工艺如下:
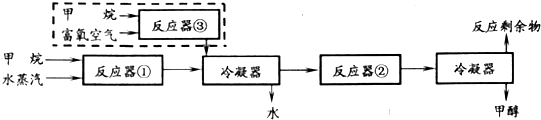
虚线框内为改进后的工艺中新增流程,所有气体体积均折算为标准状况.
(2)原工艺中,当充入反应器①的甲烷和水蒸汽的体积分别为672m3和1750m3时,最后的反应剩余物中n(CO)=10000mol,n(H2)=50000mol.
(3)为充分利用反应剩余物,该厂在原工艺的基础上,将下列反应运用于正产甲醇原料气:
2CH4(g)+O2(g)→2CO(g)+4H2(g)…③(反应中CH4转化率为100%)
若新工艺中充入反应器①的甲烷和水蒸汽的体积分别为am3和3am3,反应剩余物中V(H2):V(CO)=3:1.试计算充入反应器③的甲烷的体积.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氧气的物质的量;混合气体与氧气、水反应又得到硝酸,根据电子转移守恒,Cu原子失去的电子等于氧气获得的电子,所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀生成Cu(OH)2,由电荷守恒,OH-的物质的量等于氧气获得电子物质的量,进而计算NaOH溶液的体积;
(2)反应中CH4转化率为100%,根据反应①计算生成的CO、H2的体积,反应②中CO有$\frac{2}{3}$转化,计算参加反应的CO、H2的体积,再根据反应②计算参加反应的H2的体积,进而计算剩余CO、H2的体积,根据n=$\frac{V}{{V}_{m}}$计算它们的物质的量;
(3)假设充入反应器③的甲烷的体积为V,根据反应①、③表示出生成的CO、H2的体积,反应②中CO有$\frac{2}{3}$转化,计算参加反应的CO、H2的体积,进而计算剩余CO、H2的体积,再结合反应剩余物中V(H2):V(CO)=3:1进行计算.
解答 解:(1)1.68L氧气的物质的量$\frac{1.68L}{22.4L/mol}$=0.075mol;
混合气体与氧气、水反应又得到硝酸,根据电子转移守恒,Cu原子失去的电子等于氧气获得的电子,所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀生成Cu(OH)2,由电荷守恒,OH-的物质的量等于氧气获得电子物质的量,故n(OH-)=0.075mol×4=0.3mol,则V(NaOH)=$\frac{0.3mol}{5mol/L}$=0.06L=60mL,
故答案为:0.075mol;60mL;
(2)反应中CH4转化率为100%,甲烷和水蒸汽的体积分别为672m3和1750m3,由CH4(g)+H2O→CO(g)+3H2(g),可知水蒸气有剩余,则:
CH4(g)+H2O→CO(g)+3H2(g)
672m3 672m3 2016m3
反应②中CO有$\frac{2}{3}$转化,故参加反应的CO为672m3×$\frac{2}{3}$=448m3,由CO(g)+2H2(g)→CH3OH(g),可知参加H2的体积为449m3×2=896m3,故剩余CO为672m3-448m3=224m3,其物质的量为$\frac{224×1000L}{22.4L/mol}$=10000mol,剩余H2的体积为2016m3-896m3=1124m3,其物质的量为$\frac{1124×1000L}{22.4L/mol}$=50000mol,
故答案为:10000mol;50000mol;
(3)反应器①的甲烷和水蒸汽的体积分别为am3和3am3,假设充入反应器③的甲烷的体积为V,则:
CH4(g)+H2O→CO(g)+3H2(g) 2CH4(g)+O2(g)→2CO(g)+4H2(g)
a a 3a V V 2V
反应②中CO有$\frac{2}{3}$转化,参加反应的CO为$\frac{2}{3}$(a+V)m3,由CO(g)+2H2(g)→CH3OH(g),可知参加H2的体积为$\frac{2}{3}$(a+V)m3×2=$\frac{4}{3}$(a+V)m3,故剩余CO为$\frac{1}{3}$(a+V)m3,剩余H2的体积为(3a+2V)m3-$\frac{4}{3}$(a+V)m3=$\frac{1}{3}$(5a+2V)m3,
故$\frac{1}{3}$(5a+2V)m3:$\frac{1}{3}$(a+V)m3=3:1,解得V=2am3,
答:充入反应器③的甲烷的体积为2am3.
点评 本题考查混合物的有关计算、化学反应方程式有关计算,侧重考查学生分析计算能力,难度中等.


| A. | 甲是亚硫酸氢钠粉末投入稀硝酸溶液中的有关图象 | |
| B. | 乙是等pH的MCl2和NCl2溶液稀释时pH变化图象,由此可推测M的金属性较强 | |
| C. | 由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ•mol-1 | |
| D. | 丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图象 |
| 序号 | 甲 | 乙 | 丙 |
| A | CO2 | SO2 | 澄清石灰水 |
| B | HCl | CO2 | Ba(OH)2 |
| C | CO2 | SO2 | Ba(NO3)2 |
| D | CO2 | NH3 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
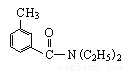 ;DEET在一定条件下,可通过下面的路线来合成:
;DEET在一定条件下,可通过下面的路线来合成:
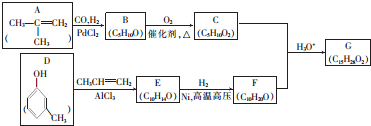
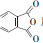 反应可生成1mol百里酚酞
反应可生成1mol百里酚酞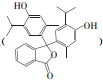
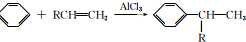
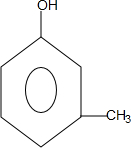 +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$ ;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.
;B→C的化学方程式为2(CH3)2CH2CH2CHO+O2$→_{△}^{催化剂}$2(CH3)2CH2CH2COOH.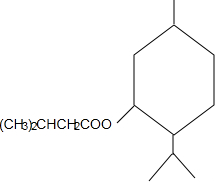 .
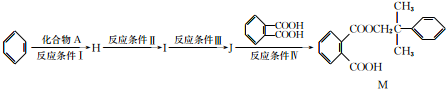
.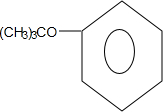 .
.
 .
.