题目内容
【题目】某课外活动小组用下图装置进行实验,试回答:
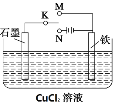
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”)铁极上的电极反应式为________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),装置中的总化学方程式为________,铁极上的现象为________,石墨电极的反应现象为________,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质在标准状况下的体积为________L。
【答案】 原电池 Fe -2e- =Fe2+ 阳极 CuCl2![]() Cu+Cl2↑ 有红色固体析出 有气泡产生 3.2 1.12
Cu+Cl2↑ 有红色固体析出 有气泡产生 3.2 1.12
【解析】(1)K接M,没有电源,为原电池,根据原电池的原理分析解答;
(2)K接N,过程电解池,石墨为惰性电极,根据电解池的原理分析解答。
(1)若开始时K接M,则该装置为原电池,其中铁为负极,铁极上的电极反应式为Fe -2e- =Fe2+,故答案为:原电池;Fe -2e- =Fe2+;
(2)若开始时K接N,则构成电解池,此时石墨与电源正极相连,为阳极,铁为阴极,电解氯化铜溶液的总化学方程式为CuCl2![]() Cu+Cl2↑,其中铁极上发生Cu2++2e-==Cu,的现象为有红色固体析出,石墨电极上发生2Cl――2e-=Cl2↑,现象为有气泡产生,若反应过程中有0.1mol的电子发生转移,则铁电极上析出铜0.05mol,质量为0.05mol×64g/mol= 3.2g,石墨极上产生0.05mol氯气,在标准状况下的体积为0.05mol×22.4L/mol=1.12 L,故答案为:阳极;CuCl2
Cu+Cl2↑,其中铁极上发生Cu2++2e-==Cu,的现象为有红色固体析出,石墨电极上发生2Cl――2e-=Cl2↑,现象为有气泡产生,若反应过程中有0.1mol的电子发生转移,则铁电极上析出铜0.05mol,质量为0.05mol×64g/mol= 3.2g,石墨极上产生0.05mol氯气,在标准状况下的体积为0.05mol×22.4L/mol=1.12 L,故答案为:阳极;CuCl2![]() Cu+Cl2↑;有红色固体析出;有气泡产生;3.2;1.12。
Cu+Cl2↑;有红色固体析出;有气泡产生;3.2;1.12。

【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______
a.反应速率![]() ( NH3) =
( NH3) =![]() ( N2)
( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是
(逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填﹥、﹤或﹦)。
(逆)(填﹥、﹤或﹦)。

(2)298 K时,若已知生成标准状况下2.24 L NH3时放出热量为4.62 kJ。写出合成氨反应的热化学方程式_______。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4 kJ,其原因是________。
(3)一定条件下,在2 L密闭容器内,反应2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |