题目内容
【题目】联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%. 电解
(1)有效“减碳”的手段之一是节能.下列制氢方法最符合的是(填字母序号).
A.电解水制氢:2H2O= ![]() 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O= ![]() 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O ![]() CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一. 已知:
CO(g)+2H2(g)═CH3OH(g)△H=Q1 kJmol﹣1
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=Q2 kJmol﹣1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=Q3 kJmol﹣1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为 .
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1p2 (填“>”、“<”或“=”),上述反应的△H0 (填“<”、“>”或“=”) 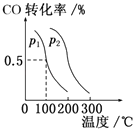
【答案】
(1)C
(2)2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=(2Q1+Q2﹣2Q3)kJ?mol﹣1
(3)<;<
【解析】解:(1)A、消耗电能,不是最节能的方法,故A错误;
B、消耗热能,不是减碳的手段,故B错误;
C、利用太阳光催化分解水制氢是最节能的,故C正确;
D、天然气是非再生能源,且不是最节能的方法,故D错误;故选:C;(2)利用盖斯定律进行计算,将三个方程式进行形式变换,
2CO(g)+4H2(g)═2CH3OH(g)△H=2Q1 kJmol﹣1
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=Q2 kJmol﹣1
﹣2CO(g)﹣2H2O(g)═﹣2CO2(g)﹣2H2(g)△H=﹣2Q3 kJmol﹣1
三式相加得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=(2Q1+Q2﹣2Q3 ) kJmol﹣1,
所以答案是:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=(2Q1+Q2﹣2Q3 ) kJmol﹣1;(3)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,相同压强下,同一容器中,增大温度,CO的转化率减小,平衡向吸热反应方向移动,所以逆反应为吸热方向,则正反应为放热反应,所以△H<0,
所以答案是:<;<.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).

 名校课堂系列答案
名校课堂系列答案


