题目内容
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是_____(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式_______。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=____(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②再通入CO___________。
(5)一氧化碳在工业上用途广泛,比如可以用来制备甲醇。甲醇是一种优质的液体燃料。利用甲醇,氧气,氢氧化钾溶液可以构成燃料电池。试写出该燃料电池的正极反应_________________。
【答案】BC 吸热 ![]() 1.0 增加 不变 O2+4e-+2H2O=4OH-
1.0 增加 不变 O2+4e-+2H2O=4OH-
【解析】
(1)化学平衡状态标志的判断,利用正反应速率等于逆反应速率,以及各物质的浓度不变,以及各相关物理量由变化到不再变化说明达到平衡;
(2)温度升高,平衡常数增大,正向移动,正反应为吸热反应;
(3)根据化学方程式写出平衡常数,利用化学方程式进行计算;
(5)燃料电池的正极反应为O2得到电子的还原反应。
(1)A、恒温恒压下,压强与物质的量成正比,该反应前后气体的物质的量不变,则压强一直不变,压强不变不能说明是否达到了平衡,A错误;
B、达到平衡时,CO的生成速率和消耗速率相当,则CO浓度不变,可以说明反应达到平衡,B正确;
C、CO2的正反应速率等于CO的逆反应速率,且成系数比,说明反应的正反应速率等于逆反应速率,达到平衡,C正确;
D、达到平衡时,CO2和CO的浓度不变,但是不一定相等,D错误;
答案为BC;
(2)根据题目信息,温度升高,平衡常数增大,说明温度升高,正向移动,正反应为吸热反应;
(3)平衡常数等于生成物的浓度幂之积与反应物浓度幂之积的比值,由于Fe和FeO为固体,浓度是定值,不带入表达式,则![]() ;CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则反应了的CO2的浓度为1mol/L,平衡时CO2的浓度为1mol/L;带入表达式计算,则
;CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则反应了的CO2的浓度为1mol/L,平衡时CO2的浓度为1mol/L;带入表达式计算,则![]() ;
;
(4)①该反应为吸热反应,升高温度,正向移动,CO2的物质的量分数减小;
②通入CO,温度不变,根据平衡常数,![]() ,K不变,则CO和CO2的浓度之比均不变,则CO2的质量分数不变;
,K不变,则CO和CO2的浓度之比均不变,则CO2的质量分数不变;
(5) 燃料电池的正极反应为O2得到电子的还原反应,电解质溶液为碱性环境,则正极反应为O2+4e-+2H2O=4OH-。

【题目】硼泥主要由MgO和SiO2组成,含有少量的Fe2O3,FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
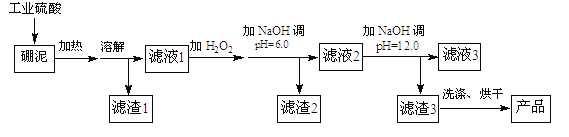
已知某些氢氧化物沉淀的PH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
(1)MgO的电子式为____。
(2)滤渣2的主要成分是 ____,向滤渣2中继续加入过量的NaOH溶液,发生的离子方程式为______。
(3)加入NaOH调节pH=12.0时,发生的离子方程式为___________。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为______。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为__(用含有a、b的代数式表示)。