题目内容
【题目】随着科学技术的发展和环保要求的不断提高,![]() 废气的处理已成为研究的热点,图1是以
废气的处理已成为研究的热点,图1是以![]() 为主要原料的化工产品的生产过程。
为主要原料的化工产品的生产过程。

(1)关于侯氏制碱法,回答下列问题:
①写出![]() 的电子式______。
的电子式______。
②实验室制取![]() 的化学方程式______。
的化学方程式______。
③由侯氏制碱法获得![]() 分为两步:
分为两步:
I.![]()
II.______。
(2)尿素是重要的氮肥,请写出由![]() 生产尿素的化学方程式______。
生产尿素的化学方程式______。
(3)![]() 催化加氢制取汽油过程中发生如下反应:
催化加氢制取汽油过程中发生如下反应:
![]()
![]()
![]()
![]()
已知:在一定温度下,10L的密闭容器中,通入![]()
![]() 和
和![]()
![]() ,反应过程如图2所示,回答下列问题:
,反应过程如图2所示,回答下列问题:
①计算该温度下反应的平衡常数![]() ______。
______。
②下列可以判断该反应达到平衡状态的是______。
![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量
的减少量等于CO的生成量
![]() 反应容器内的压强不发生变化
反应容器内的压强不发生变化
![]() 混合气体中
混合气体中![]() 的浓度不再发生改变
的浓度不再发生改变
【答案】![]()
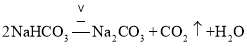
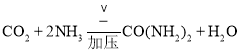 1 c
1 c
【解析】
![]() 属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子;
属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子;![]() 实验室制备氨气是利用氯化铵固体和氢氧化钙固体混合加热反应生成;
实验室制备氨气是利用氯化铵固体和氢氧化钙固体混合加热反应生成;![]() 由侯氏制碱法获得
由侯氏制碱法获得![]() 分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;
分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水;![]() 尿素是重要的氮肥,原子守恒得到由
尿素是重要的氮肥,原子守恒得到由![]() 生产尿素的反应是二氧化碳和氨气反应得到;
生产尿素的反应是二氧化碳和氨气反应得到;![]() 结合三行计算列式计算平衡浓度,平衡常数
结合三行计算列式计算平衡浓度,平衡常数![]() ;
;![]() 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
![]() 属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,
属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,![]() 的电子式为
的电子式为![]() ;
;
![]() 实验室制取
实验室制取![]() 的化学方程式为:
的化学方程式为: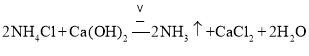 ,
,
故答案为: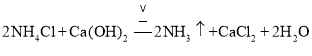 ;
;![]() 由侯氏制碱法获得
由侯氏制碱法获得![]() 分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,化学方程式为:
分为两步,第一步是氨化的饱和氯化钠溶液中通入二氧化碳生成碳酸氢钠晶体,化学方程式为:![]() ,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,化学方程式为:
,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,化学方程式为: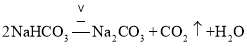 ,
,
故答案为: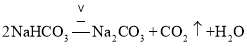 ;
;![]() 尿素是重要的氮肥,由
尿素是重要的氮肥,由![]() 生产尿素的反应是二氧化碳和氨气反应得到,反应的化学方程式:
生产尿素的反应是二氧化碳和氨气反应得到,反应的化学方程式: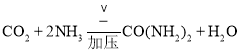 ,
,
故答案为:![]()
![]()
![]() ;
;![]() 图象可知二氧化碳物质的量变化:
图象可知二氧化碳物质的量变化:![]() ,氢气物质的量变化为
,氢气物质的量变化为![]() ,
,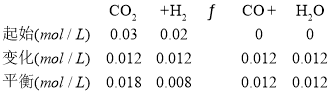
![]() ;
;![]() 反应为气体体积不变的吸热反应,
反应为气体体积不变的吸热反应,![]() 单位时间内,
单位时间内,![]() 的减少量等于CO的生成量,反应正向进行,不能说明正逆反应速率相同,故a错误;
的减少量等于CO的生成量,反应正向进行,不能说明正逆反应速率相同,故a错误;![]() 反应前后气体物质的量不变,反应容器内的压强始终不发生变化,不能说明反应达到平衡状态,故b错误;
反应前后气体物质的量不变,反应容器内的压强始终不发生变化,不能说明反应达到平衡状态,故b错误;![]() 混合气体中
混合气体中![]() 的浓度不再发生改变是平衡标志,故c正确;
的浓度不再发生改变是平衡标志,故c正确;
故答案为:c。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案