题目内容
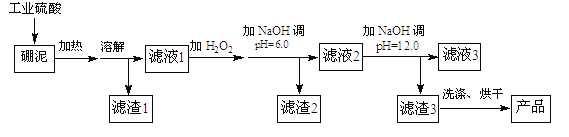
【题目】硼泥主要由MgO和SiO2组成,含有少量的Fe2O3,FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
已知某些氢氧化物沉淀的PH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.7 | 4.7 |
(1)MgO的电子式为____。
(2)滤渣2的主要成分是 ____,向滤渣2中继续加入过量的NaOH溶液,发生的离子方程式为______。
(3)加入NaOH调节pH=12.0时,发生的离子方程式为___________。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为______。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为__(用含有a、b的代数式表示)。
【答案】 Fe(OH)3、Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O Mg2++2OH-=Mg(OH)2↓ 2Mg(OH)2+2SO2+O2=2MgSO4+2H2O
Fe(OH)3、Al(OH)3 Al(OH)3+OH-=AlO2-+2H2O Mg2++2OH-=Mg(OH)2↓ 2Mg(OH)2+2SO2+O2=2MgSO4+2H2O ![]()
【解析】
硼泥主要由MgO和SiO2组成,含有少量的Fe2O3,FeO、Al2O3,在硫酸的作用下,金属氧化物与酸反应,溶液中含有Mg2+、Fe3+、Fe2+、Al3+;SiO2不与酸反应,为滤渣1的主要成分。滤液1中加入H2O2,将Fe2+氧化成Fe3+,条件pH,使Fe3+和Al3+变成Fe(OH)3和Al(OH)3与镁离子分离。条件pH=12,Mg2+转变为Mg(OH)2,最后得到MgO。
(1)MgO是离子化合物,由Mg2+和O2-构成,电子式为![]() ;
;
(2)滤液1中含有Mg2+、Fe2+、Fe3+、Al3+等金属阳离子,加入双氧水,将Fe2+氧化成Fe3+;调节pH=6,根据表格中的数据,可知,Fe3+、Al3+沉淀完全,转化为Fe(OH)3、Al(OH)3;则滤渣2的主要成分是Fe(OH)3、Al(OH)3;继续加入过量的碱,Al(OH)3会溶于过量的碱,生成AlO2-,离子方程式为Al(OH)3+OH-=AlO2-+2H2O;
(3)滤液2中的金属离子主要包括Mg2+,根据表格中的数据,Mg2+在pH=12时,完全沉淀,因此加入NaOH调节pH=12,主要发生Mg2+沉淀的反应,离子方程式为Mg2++2OH-=Mg(OH)2↓;
(4)SO2中S的化合价为+4,而产物MgSO4中S的化合价为+6,说明发生了氧化还原反应,烟气中含有O2,1molO2转移4mol电子,需要2molSO2得到电子,则SO2和O2的比例为2:1,再根据物料守恒,有化学方程式为2Mg(OH)2+2SO2+O2=2MgSO4+2H2O;
(5)根据物料守恒,MgO~Mg(OH)2,生成b吨的Mg(OH)2需要MgO![]() 吨,则硼泥中MgO的质量分数为
吨,则硼泥中MgO的质量分数为![]() 。
。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为 -69℃和58℃,写出该反应的热化学方程式___________。
(2)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9∶1,其电子式为______________。
(3)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价的含氧酸盐,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,则两种气体中相对分子质量小的气体物质的量为___________。
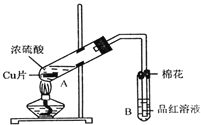
【题目】某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象______.
(2)写出A中反应的化学方程式______
(3)继续向A试管中加入![]() ,发现铜片溶解,反应的离子方程式为:______.
,发现铜片溶解,反应的离子方程式为:______.
(4)若仍不补充浓硫酸,只要求使铜片溶解,也可以加入![]() 填写两种属于不同类别物质的化学式
填写两种属于不同类别物质的化学式![]() ______、______.
______、______.
(5)![]() 试管口的棉花应沾有的试剂是______.
试管口的棉花应沾有的试剂是______.
小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体![]() 小组成员采用加热法测定该晶体里结晶水x的值.
小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量______次;
②下面是其中一次实验的数据:
坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
|
|
|
根据上表数据计算判断x的实测值比理论值![]() ______
______![]() 填“偏大”、“偏小”
填“偏大”、“偏小”![]() ,这次实验中产生误差的原因可能是______
,这次实验中产生误差的原因可能是______![]() 填序号
填序号![]()
A.硫酸铜晶体中含有不挥发的杂质![]() 实验前晶体表面有湿存水
实验前晶体表面有湿存水
C.加热时有晶体飞溅出去![]() 加热失水后露置在空气中冷却.
加热失水后露置在空气中冷却.


