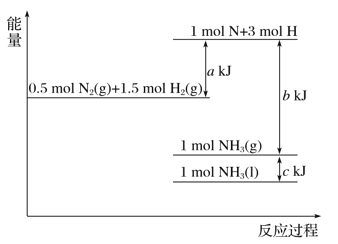
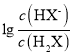题目内容
【题目】下列生产生活等实际应用中,不能用勒夏特列原理解释的是( )
A. 新制氯水中存在平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 使用更有效的催化剂,提高可逆反应的转化率
C. 工业合成NH3是放热反应,为提高NH3的产率,理论上应采取低温的措施
D. 工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2![]() 2SO3)
2SO3)
【答案】B
【解析】
勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡将向能够减弱这种改变的方向移动。勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释,据此分析解答。
A.氯水中存在平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,生成氯化银沉淀,溶液中氯离子浓度降低,平衡向右移动,氯气的浓度减小,溶液颜色变浅,可以用勒夏特列原理解释,不符合题意;
HCl+HClO,当加入AgNO3溶液后,生成氯化银沉淀,溶液中氯离子浓度降低,平衡向右移动,氯气的浓度减小,溶液颜色变浅,可以用勒夏特列原理解释,不符合题意;
B.由于催化剂不影响化学平衡,不能用勒夏特列原理解释,符合题意;
C.合成氨反应是放热的反应,降低温度,会促使平衡正向移动,可以提高氨的产率,能用勒夏特列原理解释,不符合题意;
D.通入过量空气,增加了氧气的浓度,促进平衡正向移动,二氧化硫的转化率将会增大,能用勒夏特列原理解释,不符合题意;综上所述,答案为B。

【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下
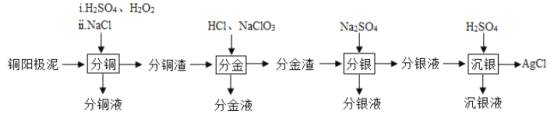
已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:
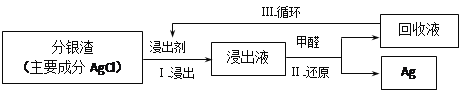
中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)