题目内容
下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH+4)=c(K+)=c(Ba2+)
B.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-)+ c(A-)=c(HA)+2 c(H+)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+ c(Na+)=c(HCO3-)+ c(CO32-)
D.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B
解析试题分析:A、等pH的氨水、KOH溶液、Ba(OH)2溶液中氢氧根和氢离子浓度相等,则根据电荷守恒可知:c(NH+4)+ c(H+)= c(OH-)、c(K+)+ c(H+)=c(OH-)、2c(Ba2+)+ c(H+)=c(OH-),所以c(NH+4)=c(K+)=2c(Ba2+),A不正确;B、0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液是NaA和HA的混合液,且二者的浓度相等,因此根据电荷守恒和物料守恒可知c(Na+)+ c(H+)= c(OH-)+ c(A-)、c(HA)+ c(A-)=2 c(Na+),所以2c(OH-)+ c(A-)=c(HA)+2 c(H+),B正确;C、向NH4HCO3溶液中滴加NaOH溶液至pH=7,根据电荷守恒可知c(NH4+)+ c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),溶液显中性,则c(H+)=c(OH-),所以c(NH4+)+ c(Na+)=c(HCO3-)+ c(CO32-),C不正确;D、将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中恰好反应生成氯化钠水和二氧化碳,最后碳酸钠过量,由于碳酸根水解,则溶液中c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-),D不正确,答案选B。
考点:考查溶液中离子浓度大小比较

下列关于盐类水解原理的叙述正确的是( )
| A.一定生成弱酸 | B.水的电离平衡不受影响 |
| C.水解过程中要吸收热量 | D.溶液的pH一定变大 |
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
| A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14 |
| B.0.01 mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 |
| C.用0.01 mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 |
| D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10 |
下列叙述中正确的是
| A.二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| B.碳酸钠溶液呈碱性,医疗上常用碳酸钠治疗胃酸过多 |
| C.向纯水中加入盐酸或降温都能使水的离子积减小,电离平衡逆向移动 |
| D.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
HF为一元弱酸,在0.1mol·L-1 NaF溶液中,离子浓度关系正确的是
| A.c(Na+)>c(F-)>c(H+)>c(OH-) | B.c(Na+)>c(OH-)>c(F-)>c(H+) |
| C.c(Na+) + c(OH-)=c(F-) + c(H+) | D.c(Na+) + c(H+)=c(F-) + c(OH-) |
下列各溶液中,各粒子的物质的量浓度关系正确的是
| A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-) |
| B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) + c(HCO3-) + c(H+) |
| D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S) |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
现有常温下的五种溶液(如下表)。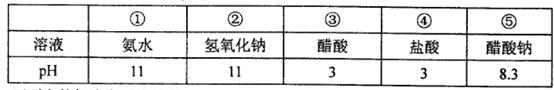
下列有关叙述中正确的是
| A.五种溶液中,水电离出的c(OH-)最小的是⑤ |
| B.将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)> c(OH-)。 |
| C.分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④ |
| D.在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(CH3COO-)> c(Cl-)>c(OH-)= c(H+)。 |
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则
| A.b、c两点溶液的导电能力相同 |
B.c点溶液中 |
| C.a、b、c三点溶液中水的电离程度a>c>b |
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积 |