题目内容
下列各溶液中,各粒子的物质的量浓度关系正确的是
| A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-) |
| B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-) |
| C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) + c(HCO3-) + c(H+) |
| D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S) |
D
解析试题分析:A.根据电荷守恒可得c(Na+) + c(H+) =2c(CO32-) + c(HCO3-) + c(OH-)。错误。B.在0.1mol/(NH4)2SO4溶液中存在电离:(NH4)2SO4="2" NH4++ SO42-,所以c(NH4+) >c(SO42-);由于该盐是强酸弱碱盐,NH4+水解消耗水电离产生的OH-,破坏了水的电离平衡,最终使溶液显酸性,c(H+) > c(OH-),但是弱电解质的电离作用远小于盐的电离,c(SO42-) >c(H+)所以在溶液中两种浓度关系为:c(NH4+) >c(SO42-)>c(H+)> c(OH-)。错误。C.在0.1mol/LNaHCO3溶液中根据质子守恒可得:c(OH-) = c(H+) +c(H2CO3) -c(CO32-)。错误。D.在0.1mol/LNa2S溶液中,根据物料守恒可得:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S)。正确。
考点:考查离子浓度的大小比较的知识。

下列说正确的是
【已知:HClO的Ka=3.0×l0-8;H2CO3的Ka1= 4.3×l0-7,Ka2=5.6×l0-11;Ksp(BaSO4)=" 1.1" ×10-10;Ksp(BaCO3)=" 5.1" ×10-9】
| A.相同条件下,pH相同的NaClO和Na2CO3溶液,物质的量浓度前者小于后者 |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时: c(Na+)>c(CH3COO-)>c(Cl-) >c(CH3COOH)>c(H+)=c(OH-) |
| C.向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3小 |
| D.氯碱工业使用的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。除杂时,粗盐水中可先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后滤去沉淀,所得滤液中仍含有一定量的SO42- |
下列叙述正确的是 ( )
| A.将过量CO2气体通入水玻璃中可制得硅酸和纯碱 |
B.标准状况下,2.24L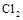 与过量稀NaOH溶液反应,转移电子0.1mol 与过量稀NaOH溶液反应,转移电子0.1mol |
| C.1L2mol·L-1明矾经水解可得到氢氧化铝胶体粒子数目为2×6.02×1023 |
| D.漂白粉溶于水能导电,故漂白粉是电解质 |
下表是常温下的五种溶液,下列有关叙述中正确的是( )
| | ① | ② | ③ | ④ | ⑤ |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
B.在⑤中加入适量④至溶液呈中性,所得溶液:c(Cl-)>c(Na+)
C.分别将①~④加水稀释至原溶液体积的100倍后溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合所得溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(6分)(2012?广东)对于常温下pH为2的盐酸,传述正确的是( )
| A.c(H+)=c(Cl﹣)+c(OH﹣) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由H2O电离出的c(H+)=1.0×10﹣12 mol?L﹣1 |
| D.与等体积0.01 mol?L﹣1乙酸钠溶液混合后所得溶液中:c(Cl﹣)=c(CH3COO﹣) |
相同温度,浓度均为0.1mol /L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如右图所示,下列说法正确的是( )
| A.上述三种溶液中:c( OH-)大小:③ > ② > ① |
| B.物质酸性的比较:CH3COOH > HF > H2CO3 |
| C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- ) |
| D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L |
 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1