题目内容
【题目】(14分)新型洁净能源能够解决环境污染、能源短缺等问题,真正把“绿水青山就是金山银山”落实到我国的各个角落。氢气作为清洁高效、可持续“零碳”能源被广泛研究,而水煤气变换反应(WGSR)是一个重要的制氢手段。
(1)WGSR 的氧化还原机理和羧基机理如图所示。则热化学方程式CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH中,对ΔH表述错误的是________(填字母)。
CO2(g)+H2(g) ΔH中,对ΔH表述错误的是________(填字母)。
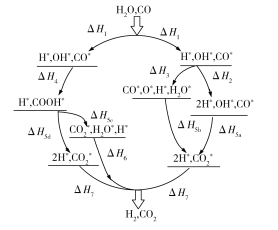
A.氧化还原机理途径:ΔH=ΔH1+ΔH2+ΔH5a+ΔH7
B.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5d+ΔH7
C.氧化还原机理途径:ΔH=ΔH1+ΔH3+ΔH5a+ΔH7
D.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5c+ΔH7
E.ΔH=ΔH1+![]() +ΔH7
+ΔH7
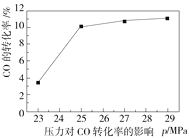
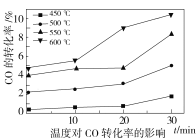
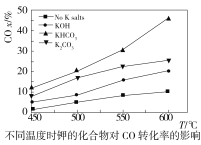
(2)水煤气变换反应在不同条件时CO的转化率不同,下图为压力、温度、不同温度时钾的化合物对CO的转化率的影响关系图,请认真观察图中信息,结合自己所学知识及生产实际,写出水煤气变换反应的条件:温度选择________℃;钾的化合物中_______催化效果最明显;压力选择______Mpa,选用此压力的原因为________。
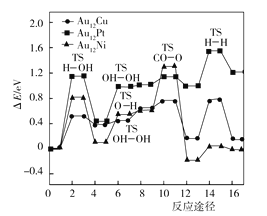
(3)如图是Au12Cu、Au12Pt、Au12Ni三种催化剂在合金团簇上WGSR最佳反应路径的基元反应能量图,反应能垒(活化能)最_______(填“高”或“低”)的步骤,为整个反应的速控步骤;三种催化剂催化反应的速控步骤__________(填“相同”或“不相同”);三种催化剂中,___________在合金团簇上的WGSR各基元反应能垒较小,对 WGSR 表现出较好的催化活性。
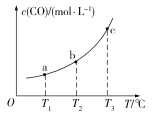
(4)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为____________。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。若T1、T2、T3时的平衡常数分别为K1、K2、K3,则K1、K2、K3由小到大的关系为____________。
【答案】CD(2分) 600(1分) KHCO3(1分) 25(1分) 在23~25 MPa,随着压力的升高,CO 转化率先快速增加,但在压力达到 25 MPa之后,CO 转化率的增加减缓(2分) 高(1分) 不相同(1分) Au12Cu(2分) K3<K2<K1(3分)
【解析】
(1)根据盖斯定律可知①ΔH=ΔH1+ΔH2+ΔH5a+ΔH7;②ΔH=ΔH1+ΔH3+ΔH5b+ΔH7;③ΔH=ΔH1+ΔH4+ΔH5d+ΔH7;④ΔH=ΔH1+ΔH4+ΔH5c+ΔH6,E项可由(①+③)÷2得出。
(2)根据温度对CO转化率的影响图可知,600℃,CO转化率最高,故温度选择600 ℃;根据不同温度时钾的化合物对CO转化率的影响图可知,相同温度时KHCO3对CO转化率高,故选KHCO3;根据压力对CO转化率的影响图可知,在23~25 MPa,随着压力的升高,CO 转化率先快速增加,但在压力达到 25 MPa之后,CO 转化率的增加减缓,综合各种因素,25 MPa时比较经济实惠,故选择25 MPa。
(3)反应能垒(活化能)最高的步骤,是反应最慢的步骤,也是整个反应的速控步骤;由反应途径图可知,三种催化剂催化的反应能垒最高的步骤不一致,有前有后,速控步骤不相同;由反应途径图可知,Au12Cu在合金团簇上的 WGSR各基元反应能垒较小,对 WGSR 表现出较好的催化活性。
(4)由题图可知,温度越高平衡时c(CO)越大,说明升高温度,平衡向逆反应方向移动,即ΔH<0,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,化学平衡常数减小,故K3<K2<K1。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案