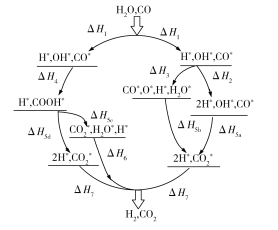
题目内容
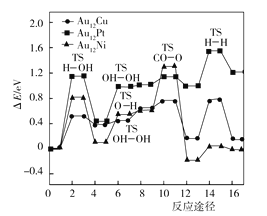
【题目】化学反应A2(g)+B(g)=2AB(g)的能量交化如图所示。下列有关叙述不正确的是

A.AB(g)的键能为b kJ·mol-1
B.反应热△H=+(a-b)kJ·mol-1
C.该反应中反应物的总能量低于生成物的总能量
D.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
【答案】A
【解析】
由图可知,正反应的活化能即断裂1molA-A键和1molB-B键所需的能量为akJ,逆反应的活化能即断裂2molA-B键所需的能量为bkJ,反应热△H=断开化学键所需的能量-形成化学键放出的能量,由于反应物的总能量小于生成物的总能量,故反应吸热。
A.bkJ能量是断裂2molAB键所需的能量或形成2molAB所放出的能量,故A错误;
B.反应热△H=断开化学键所需的能量形成化学键放出的能量=+(ab)kJmol1,故B正确;
C.从图可以看出,此反应的反应物的总能量小于生成物的总能量,故C正确;
D.正反应的活化能为akJ,即断裂1molAA键和1molBB键所需的能量为akJ,故D正确。
答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
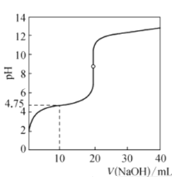
【题目】实验室制备乙酸丁酯的环境温度(反应温度)是115﹣125℃,其它有关数据如下表,则以下关于实验室制备乙酸丁酯的叙述错误的是( )
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 | 98%浓硫酸 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
溶解性 | 溶液水和有机物 | 溶液水和有机物 | 微溶于水,溶液有机物 | 与水混合 |
A.相对价廉的乙酸与1﹣丁醇的物质的量之比应大于1:1
B.不用水浴加热是因为乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用Na2CO3溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏