题目内容
【题目】光卤石(组成为KCl·MgCl2·nH2O)是制取钾肥和冶炼金属镁的重要原料。为测定光卤石的组成,某化学小组在实验室进行如下实验。回答下列问题:
(一)光卤石中结晶水含量测定,所用装置如图所示。
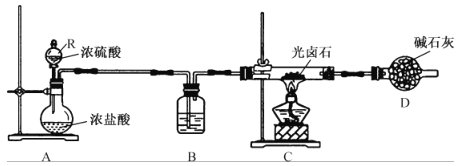
(1)装置A的作用是_____________,其中仪器 R的名称是_______。装置B盛放的试剂是______;装置D的作用是_____________________________。
(2)实验包括如下步骤,正确的先后顺序为____________(填序号)。
①点燃装置C中的酒精灯;②打开装置A中R的活塞;③组装仪器,并检查装置的气密性;④装入药品;⑤关闭装置A中R的活塞;⑥熄灭装置C中的酒精灯。
(3)写出装置C中硬质玻璃管内发生反应的化学方程式:________________________(光卤石用“KCl·MgCl2·nH2O”表示)。
(4)若装置C中硬质玻璃管的质量为ag,实验前称量得硬质玻璃管和样品的总质量为bg,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为cg。则KCl·MgCl2·nH2O中n=______(用含a、b、c的代数式表示)。
(二)测定纯净的光卤石中Mg2+的质量分数。
取wg纯净的光卤石溶于稍过量的稀硝酸中,再用水稀释,配制成250mL溶液。取25.00 mL溶液于锥形瓶中,滴几滴K2CrO4溶液(作指示剂),用c mol·L-1的AgNO3标准溶液滴定至终点,消耗V mL AgNO3标准溶液。
(5)纯净的光卤石中所含镁元素的质量分数为_____%(用含w、c、V的代数式表示)。
(6)其他操作均正确,若滴定开始时仰视读数,滴定终点时俯视读数,则测得的结果会_____(填“偏高”偏低”或“无影响”)。
【答案】制取 HCl气体 分液漏斗 浓硫酸 吸收尾气中的氯化氢、水蒸气及空气中的水蒸气 ![]()
![]()
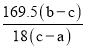
![]() 偏低
偏低
【解析】
A中浓硫酸使HCl逸出,B中为浓硫酸干燥HCl气体,C中发生![]() ,装置C中硬质玻璃管的质量为ag,实验前称量得硬质玻璃管和样品的总质量为bg,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为cg,可知
,装置C中硬质玻璃管的质量为ag,实验前称量得硬质玻璃管和样品的总质量为bg,充分反应并冷却后,称量得硬质玻璃管和剩余固体的总质量为cg,可知![]() 的质量为
的质量为![]() ,生成水的质量为
,生成水的质量为![]() ,生成KCl和
,生成KCl和![]() 的质量为
的质量为![]() ,D中碱石灰可吸收尾气,且防止空气中水进入C中,以此来解答。
,D中碱石灰可吸收尾气,且防止空气中水进入C中,以此来解答。
(1)装置A的作用是制取 HCl气体,由图可知,R是分液漏斗,装置B中的试剂是浓硫酸,装置D的作用是吸收尾气中的氯化氢、水蒸气及空气中的水蒸气,故答案为:制取HCl气体;分液漏斗;浓硫酸;吸收尾气中的氯化氢、水蒸气及空气中的水蒸气;
(2)实验时先检验装置的气密性,然后加药品,打开装置A处的分液漏斗的活塞,点燃装置C处的酒精灯,熄灭装置C处的酒精灯,最后关闭A处的分液漏斗的活塞,实验步骤的先后顺序为![]() ,故答案为:
,故答案为:![]() ;
;
(3)装置C中硬质玻璃管内发生反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)![]() 的质量为
的质量为![]() ,生成水的质量为
,生成水的质量为![]() ,生成KCl和
,生成KCl和![]() 的质量为
的质量为![]() ,则
,则![]() ,即
,即![]() 中
中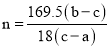 ,故答案为:
,故答案为: ;
;
(5)由![]() 可知,纯净的光卤石中所含
可知,纯净的光卤石中所含![]() 的质量分数为
的质量分数为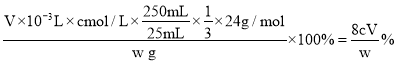 ,故答案为:
,故答案为:![]() %;
%;
(6)若滴定开始时仰视读数,滴定终点时俯视读数,消耗硝酸银溶液的体积偏小,则测得的结果会偏低,故答案为:偏低。

【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。
【题目】某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0g Na2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2的电子式为___________。它与水反应的离子方程式是__________________。
(2)甲同学认为ⅱ中溶液褪色是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应,并实验证实了H2O2的存在;取少量溶液a,加入试剂___________(填化学式),有气体产生。
(3)乙同学查阅资料获悉:用KMnO4可以氧化H2O2并测定其含量。取20.00mL溶液,用稀H2SO4酸化,用0.002mol/L KMnO4溶液滴定,产生气体,溶液褪色,至终点时共消耗10.00mL KMnO4溶液。
①实验中,滴定时KMnO4溶液应装在__________(酸或碱)式滴定管中。
②用单线桥标出该反应电子转移的方向和数目:_______________。
2MnO4-+5H2O2+6H+ = 2Mn2++5O2↑+8H2O。
③溶液a中 c(H2O2)=___________ mol/L。