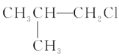题目内容
【题目】[化学——选修3:物质结构与性质](15分)
锌是人体必需的微量元素之一,起着极其重要的作用,回答下列问题:
(1)请写出Zn2+的核外电子排布式_____________________。
(2)ZnCl2熔点为275 ℃,而CaCl2的熔点为782 ℃,请分析熔点不同的原因:_________。
(3)Zn2+能与多种微粒形成配合物,如Zn2+与CNO可形成[Zn(CNO)4]2,[Zn(CNO)4]2中配位原子为__________,[Zn(CNO)4]2的组成中非金属元素的电负性大小顺序为____________;Zn2+与CN可形成[Zn(CN)4]2,[Zn(CN)4]2中σ键、π键和配位键的个数比为________;配合物Zn(NH3)4CO3中阴离子的空间构型为____________,N原子的杂化方式为____________。
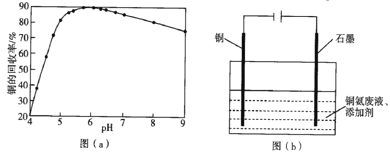
(4)Zn与S所形成化合物的晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图:
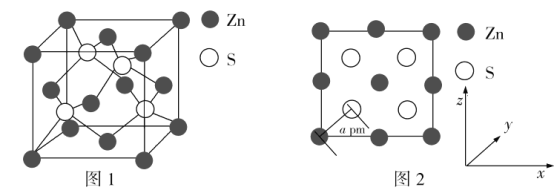
①晶胞中S原子的配位数为_________。
②晶胞中最近的两个S原子之间的距离为_______pm。
③设阿伏加德罗常数的值为NA,则该晶胞的密度是__________g·cm3(列出计算表达式)。
[化学——选修5:有机化学基础](15分)
哌替啶盐酸盐G有镇痛作用,其合成路线如下。回答下列问题:
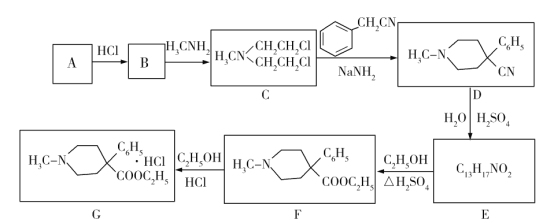
(1)写出A的结构简式:________;B中含有碳碳双键,则B的名称为_____________。
(2)G中含氧官能团名称为____________;B→C的反应类型为_________________。
(3)E的结构简式为_____________。
(4)写出C→D的化学方程式:_______________________________________。
(5)M与E互为同分异构体,符合下列条件的M有______种。
①属于芳香α-氨基酸;
②含有两个六元环。
其中一种同分异构体,—NH2被H原子取代后,除苯基上H原子外,其他核磁共振氢谱的峰面积比为4∶4∶1∶1∶1,该同分异构体的结构简式为______________。
(6)请结合以上合成路线,写出以H3CNHCH2Cl和CH2=CHCl及上述流程中出现的物质为原料合成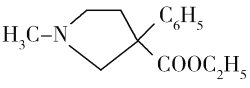 的路线______________________。
的路线______________________。
【答案】1s22s22p63s23p63d10(或[Ar]3d10)(1分) CaCl2为典型的离子化合物,而ZnCl2虽为离子化合物,但有明显的共价性(1分) O(1分) O > N >C(1分) 2∶2∶1(2分) 平面三角形(2分) sp3(1分) ①4(1分) ②2a(2分) ③![]() (3分) CH≡CH(1分) 氯乙烯(1-氯乙烯)(1分) 酯基(1分) 加成反应(1分)
(3分) CH≡CH(1分) 氯乙烯(1-氯乙烯)(1分) 酯基(1分) 加成反应(1分) 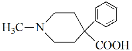 (2分)
(2分) 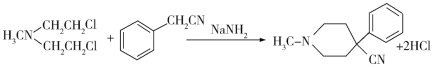 (2分) 3(1分)
(2分) 3(1分)  (2分)
(2分) 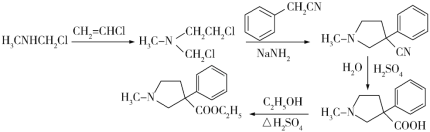 (4分)
(4分)
【解析】
[化学——选修3:物质结构与性质]
(1)Zn的原子序数为30,其核外电子排布式为[Ar]3d104s2,Zn2+是锌原子失去2个电子所形成的,Zn2+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10。
(2)Ca的金属性比Zn的强,Ca、Zn与氯形成CaCl2、ZnCl2,其中CaCl2为典型的离子化合物,熔点比较高,而ZnCl2虽为离子化合物,但因Zn的活泼性比较弱,形成的ZnCl2有明显的共价性,使ZnCl2熔点比CaCl2低。
(3)配位原子必须能提供孤电子对,而CNO结构中,O能提供孤电子对,故配位原子为O原子,[Zn(CNO)4]2中非金属元素为C、N、O,同一周期从左至右,电负性逐渐增大,它们的电负性大小顺序为O> N>C,一个[Zn(CN)4]2中Zn与4个CN间有4个配位键即4个σ键,每个CN之间存在一个σ键和2个π键,σ与π和配位键的个数为8、8、4,比值为 2∶2∶1。Zn(NH3)4CO3中阴离子为![]() ,是平面三角形,NH3中的N是sp3杂化。
,是平面三角形,NH3中的N是sp3杂化。
(4)①根据图可看出每一个S周围有4个Zn,配位数为4。②最近的两个S原子之间的距离是面对角线的一半,根据图2可知面对角线长为4a pm。最近的两个S原子之间的距离是2a pm。③晶胞中Zn的个数为顶点8×![]() =1,面心6×
=1,面心6×![]() =3,共4个,S在内部,共4个,化学式为ZnS,式量为65+32,设晶胞边长为d pm,
=3,共4个,S在内部,共4个,化学式为ZnS,式量为65+32,设晶胞边长为d pm,![]() =4a,d=
=4a,d=![]() ,ρd3NA=4(65+32)span>,ρ =
,ρd3NA=4(65+32)span>,ρ =![]() g·cm3。
g·cm3。
[化学——选修5:有机化学基础]
(1)根据A→B→C,可看出A与HCl和H3CNH2发生连续加成反应,所以A含有碳碳叁键,为乙炔,结构简式为CH≡CH,B中含有碳碳双键,是A与HCl加成所得,所以B为氯乙烯。
(2)根据合成路线可知,G中含氧官能团为酯基,B生成C,发生加成反应。
(3)根据D、F的结构,可知E中含羧基,得出E的结构简式为 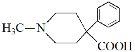 。
。
(4)C生成 D发生了取代反应,方程式为:
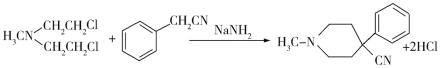 。
。
(5)苯环在1,2,3位时都满足条件,即 ,
, 中—NH2被H代替后为
中—NH2被H代替后为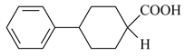 ,除苯环外,其他C原子上的H原子个数如下:
,除苯环外,其他C原子上的H原子个数如下: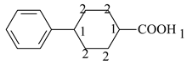 ,核磁共振氢谱峰面积比正好为4∶4∶1∶1∶1。
,核磁共振氢谱峰面积比正好为4∶4∶1∶1∶1。
(6)利用题干B→C→D→E→F的反应原理,B→C为双加成反应,而所设计的合成路线中为单加成反应,题干中C→D和所设计合成路线中一样均为双取代反应,题干中D→E→F与所设计合成路线中一样均为水解、酯化反应,所以合成路线为:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案