题目内容
5.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同.将1.0体积的这种混合气体在氧气中充分燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃为C2H6(写分子式,下同),烯烃为C2H4,烷烃和烯烃的体积比为2:3.分析 1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,则平均碳原子数为:$\frac{2}{1}$=2,平均氢原子数为:$\frac{2.4}{1}$×2=4.8;二者分子中碳原子数相等,则都含有2个碳原子,应该为乙烷和乙烯的混合物;设乙烷的体积为x,乙烯的体积为y,根据混合物中平均氢原子数列式计算出x:y即可.
解答 解:相同条件下,气体的体积之比等于物质的量之比,1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,混合气体的物质的量与生成二氧化碳的物质的量之比为:1:2,则混合气体中平均碳原子数为:$\frac{2}{1}$=2,
混合物体积与水的物质的量之比为:1:4.8,则混合物中平均氢原子数为:$\frac{2.4}{1}$×2=4.8,
由于烯烃和烷烃分子中的碳原子数相等,则混合物为乙烷和乙烯,
设乙烷的体积为x,乙烯的体积为y,
混合物中平均氢原子数为:$\frac{6x+4y}{x+y}$=4.8,
解得:x:y=2:3,
故答案为:C2H6;C2H4; 2:3.
点评 本题考查烷烃和烯烃的燃烧及相关计算,题目难度中等,注意掌握混合烃燃烧的计算方法,明确平均分子式法在化学计算中的运用方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
10.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法研究影响反应速率的因素.
该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01mol•L-1、0.001mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.1mol•L-1、0.2mol•L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K.
(1)每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
①用0.001mol•L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol•L-1•min-1
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”)否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况.
该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01mol•L-1、0.001mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.1mol•L-1、0.2mol•L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K.
(1)每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
| KMnO4酸性溶液的浓度 (mol•L-1) | 溶液褪色所需时间 (min) | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”)否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况.
11.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 金属钠在氯气中燃烧生成氯化钠 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
20.下列各组有机物中,只需加入溴水就能一一鉴别的是( )
| A. | 已烯、苯、四氯化碳 | B. | 已炔、己烯、四氯化碳 | ||
| C. | 已烷、苯、乙醇 | D. | 甲苯、苯、已烯 |
10.关于下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④太阳能、氢能和海洋能都属于新能源;⑤置换反应都属于离子反应.其中正确的是( )
| A. | ①②⑤ | B. | ①②④ | C. | ②③④ | D. | ③④⑤ |
17.下列方程式书写正确的是( )
| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |
14.下列说法正确的是( )
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 非极性共价键只能存在于非金属单质中,不可能存在于化合物中 | |
| C. | 含有离子键的化合物一定是离子化合物,在离子化合物中可以含有非极性共价键 | |
| D. | 凡是能电离出离子的化合物都是离子化合物 |
15.下列有机物的结构表示不正确的是( )
| A. | CH4的球棍模型示意图为 | B. | 丁烯的键线式为 | ||
| C. | 乙醇的结构式为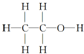 | D. | 乙酸的最简式为CH2O |