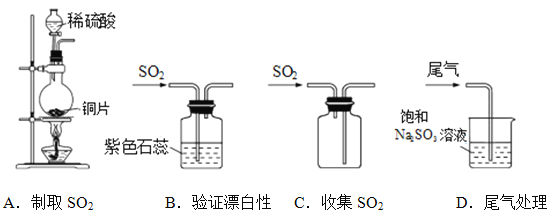
题目内容
【题目】设 NA 代表阿伏加德罗常数的数值,下列说法正确的是
A. 2.4 g 金属镁变成镁离子时失去的电子数目为 0.1NA
B. 18 g 水中含有 0.1NA 个水分子
C. 22.4 L 氮气所含的电子数目为 NA
D. 17 g 氨气所含电子数目为 10NA
【答案】D
【解析】
A. 2.4gMg物质的量=![]() =0.1mol,每个Mg失2个电子形成Mg2+,则0.1molMg失去0.2mol电子,即失去电子数目为0.2NA,A项错误;
=0.1mol,每个Mg失2个电子形成Mg2+,则0.1molMg失去0.2mol电子,即失去电子数目为0.2NA,A项错误;
B.18g水的物质的量为1mol,1molH2O中含有NA个水分子,B项错误;
C.气体所处的温度和压强未知,无法得知气体摩尔体积,无法计算22.4L氮气物质的量,也就无法计算所含电子数目,C项错误;
D.17g氨气的物质的量为1mol,每个NH3分子含有10个电子,所以1molNH3含有电子数目为10NA,D项正确;答案选D。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
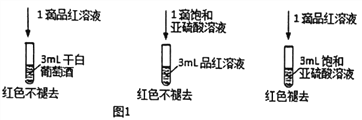
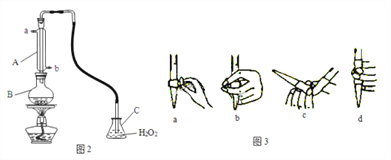
英语小英雄天天默写系列答案【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中的SO2,并对含量进行测定。实验步骤如下
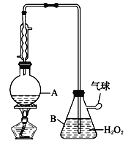
i. 检查装置的气密性后,向仪器A中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与B中H2O2完全反应
iii. 除去B中过量的H2O2后,将B中溶液取出,稀释至100mL
iv.取25.00mL 稀释后的溶液至于锥形瓶中,加入几滴酚酞
v.用0.0300mol/L NaOH标准溶液进行滴定,重复三次
(1)SO2在水中可形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用化学方程式表示为_______________。
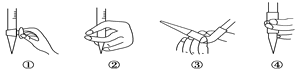
(2)图中①中仪器名称为_____________,步骤v中,滴定前排气泡时,应选择图中的___。
(3)除去过量H2O2的方法是_________________。
(4)滴定的终点现象_____________________________________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(5)滴定消耗的NaOH溶液的体积如下,则该葡萄酒中SO2含量为____g/L。
滴定次数 | 1 | 2 | 3 |
NaOH溶液体积/mL | 21.80 | 20.02 | 19.98 |
(6)某同学认为该测定结果不能说明该葡萄酒中SO2残留量一定超标。原因是__________。利用现有装置可以如何改进?_____________。