题目内容
【题目】葡萄酒中添加的SO2有抗氧化和杀菌等作用。中华人民共和国国家标准规定葡萄酒中SO2最大使用量为0.25g/L。
I.SO2的制取和部分性质研究。
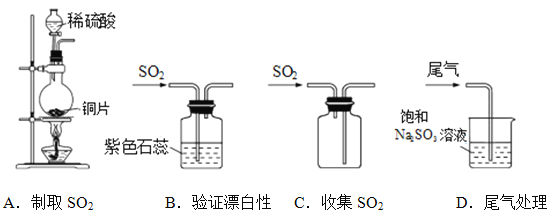
(1)下列实验室制取、验证漂白性、收集及尾气处理的装置和原理能达到实验目的的是____________
(2)设计实验验证SO2与Fe2+ 还原性的强弱(可供选择的试剂有:FeCl2溶液、氯水、KSCN溶液、Ba(NO3)2溶液、BaCl2溶液、KMnO4溶液)。取SO2的饱和溶液,向其中滴加少量FeCl3溶液,充分反应。将反应后混合液分成甲、乙两份。
向甲中滴加_________溶液,观察到_____________, 可知混合液中无Fe3+;
向乙中滴加_________溶液,观察到______________,可知混合液中有__________由此得出结论:SO2的还原性强于Fe2+ 。
II.葡萄酒中SO2的检测。
(3)检测干白葡萄酒(液体为无色)中的SO2或HSO3-。设计如图1的实验:
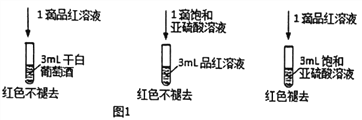
甲同学得出实验结论:干白葡萄酒中不含SO2或HSO3-。这个结论是否合理_____(填“是”或“否”)说明理由__________________________________________。
(4)某兴趣小组用图2装置(夹持装置略)收集某葡萄酒中SO2,并对含量进行测定。
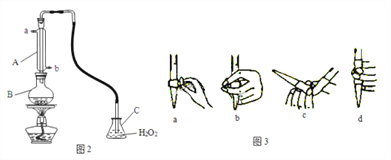
实验步骤:
i. 检查装置的气密性后,向图2仪器B中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与C中H2O2完全反应
iii. 除去C中过量的H2O2
iv. 用0.0900mol/LNaOH标准溶液进行滴定
回答下列问题:
①仪器A的名称是____,A的进水口为____,滴定前排气泡时,应选择图3中的___。
②C中反应生成物的化学式是________,除去过量H2O2的方法是_________________。
③滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为____g/L,是否符合国家标准________(填“是”或“否”)。
④下列操作使测定结果比实际值偏高的是______________。
a.B中加入的盐酸挥发
b.滴定终点读取滴定管刻度时,俯视标准液液面
c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容
【答案】 D KSCN 溶液不变红色(或无明显现象) BaCl2溶液 生成白色沉淀 SO42- 否 实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量很低,所以也不能使品红褪色(合理给分) 冷凝管 b c H2SO4 加热法 0.24 是 a
【解析】(1)A、需用浓H2SO4与Cu反应制取SO2,选项A不能达到实验目的;B、SO2可以使品红溶液褪色,以验证其具有漂白性,但使紫色石蕊变红是证明其与水反应生成的亚硫酸呈酸性,选项B不能达到实验目的;C、SO2的密度比空气大,应用向上排空气法收集,导气管应“长进短出”,选项C不能达到实验目的;D、SO2与饱和Na2SO3溶液反应而被吸收,选项D能达到实验目的。答案选D;(2)向甲中滴加KSCN溶液,观察到溶液不变红色(或无明显现象), 可知混合液中无Fe3+;向乙中滴加BaCl2溶液溶液,观察到生成白色沉淀,可知混合液中有SO42-由此得出结论:SO2的还原性强于Fe2+ 。(3)结论不合理,实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量很低,所以也不能使品红褪色;(4)①仪器A的名称是冷凝管,A的进水口为b,滴定前排气泡时,应选择图3中的c;②C中反应生成物为硫酸,化学式是H2SO4,除去过量H2O2的方法是加热法;③(6)根据2NaOH~H2SO4~SO2可知SO2的质量为: ![]() ×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:
×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为: ![]() =0.24g/L<0.25g/L, 符合国家标准;④a.由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,所以会导致测定结果比实际值偏高;b.滴定终点读取滴定管刻度时,俯视标准液液面,标准液体积偏小,浓度偏低;c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容,标准溶的浓度偏高,消耗体积偏小,测定结果偏低,答案选a。
=0.24g/L<0.25g/L, 符合国家标准;④a.由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,所以会导致测定结果比实际值偏高;b.滴定终点读取滴定管刻度时,俯视标准液液面,标准液体积偏小,浓度偏低;c.配制NaOH标准溶液时,未等烧杯中溶液冷却至室温即转移定容,标准溶的浓度偏高,消耗体积偏小,测定结果偏低,答案选a。
。