题目内容
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组用下图装置(夹持装置略)收集某葡萄酒中的SO2,并对含量进行测定。实验步骤如下

i. 检查装置的气密性后,向仪器A中加入300.00ml葡萄酒和适量盐酸
ii. 加热使SO2全部逸出并与B中H2O2完全反应
iii. 除去B中过量的H2O2后,将B中溶液取出,稀释至100mL
iv.取25.00mL 稀释后的溶液至于锥形瓶中,加入几滴酚酞
v.用0.0300mol/L NaOH标准溶液进行滴定,重复三次
(1)SO2在水中可形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用化学方程式表示为_______________。
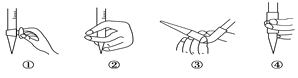
(2)图中①中仪器名称为_____________,步骤v中,滴定前排气泡时,应选择图中的___。
(3)除去过量H2O2的方法是_________________。
(4)滴定的终点现象_____________________________________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(5)滴定消耗的NaOH溶液的体积如下,则该葡萄酒中SO2含量为____g/L。
滴定次数 | 1 | 2 | 3 |
NaOH溶液体积/mL | 21.80 | 20.02 | 19.98 |
(6)某同学认为该测定结果不能说明该葡萄酒中SO2残留量一定超标。原因是__________。利用现有装置可以如何改进?_____________。
【答案】 SO2(g)![]() SO2(aq);SO2+H2O
SO2(aq);SO2+H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H+ + HSO3-;HSO3-
H+ + HSO3-;HSO3-![]() H+ +SO32- 酸式滴定管 ③ 加入二氧化锰并振荡 滴入最后一滴溶液,锥形瓶溶液由无色变为浅红色且半分钟不褪色 ④ 0.2560 原因:可能有盐酸挥发进入B瓶中 改进措施:用蒸馏水代替葡萄酒进行对比实验或用不挥发的强酸如硫酸代替盐酸,排除盐酸挥发的影响
H+ +SO32- 酸式滴定管 ③ 加入二氧化锰并振荡 滴入最后一滴溶液,锥形瓶溶液由无色变为浅红色且半分钟不褪色 ④ 0.2560 原因:可能有盐酸挥发进入B瓶中 改进措施:用蒸馏水代替葡萄酒进行对比实验或用不挥发的强酸如硫酸代替盐酸,排除盐酸挥发的影响
【解析】试题分析:(1)SO2 ─饱和H2SO3溶液体系中存在SO2溶解平衡、SO2与水的反应平衡、亚硫酸的电离平衡;(2)根据图示回答图中①仪器名称;氢氧化钠溶液是碱性溶液,用碱式滴定管,碱式滴定管排气泡的方法是:把滴定管的胶头部分向上弯曲,再排气泡;(3)H2O2用二氧化锰做催化剂可以分解为水和氧气;(4)酚酞在酸性溶液中呈无色,在碱性溶液中为红色;滴定管0刻度线在上方,尖嘴部分没有刻度线;(5)第一次实验数值偏离正常误差范围,根据第二次、第三次实验数据,平均消耗氢氧化钠溶液的体积是20.00 mL,根据关系式![]() 计算SO2含量;(6)盐酸挥发进入B瓶中;
计算SO2含量;(6)盐酸挥发进入B瓶中;
解析:(1)SO2 ─饱和H2SO3溶液体系中存在SO2溶解平衡SO2(g)![]() SO2(aq)、SO2与水的反应平衡SO2+H2O
SO2(aq)、SO2与水的反应平衡SO2+H2O![]() H2SO3、亚硫酸的电离平衡H2SO3
H2SO3、亚硫酸的电离平衡H2SO3![]() H+ + HSO3-、HSO3-
H+ + HSO3-、HSO3-![]() H+ +SO32-;(2)根据图示,图中①仪器是酸式滴定管;氢氧化钠溶液是碱性溶液,用碱式滴定管,碱式滴定管排气泡的方法是:把滴定管的胶头部分向上弯曲,再排气泡,所以用③的方法;(3)H2O2用二氧化锰做催化剂可以分解为水和氧气,所以除去过量H2O2的方法是加入二氧化锰并振荡;(4)酚酞在酸性溶液中呈无色,在碱性溶液中为红色,滴定的终点现象是滴入最后一滴溶液,锥形瓶溶液由无色变为浅红色且半分钟不褪色;滴定管0刻度线在上方,尖嘴部分没有刻度线,若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积>40 mL,选④;(5)第一次实验数值偏离正常误差范围,根据第二次、第三次实验数据,平均消耗氢氧化钠溶液的体积是20.00 mL,设300.00ml葡萄酒中含SO2的质量为ag
H+ +SO32-;(2)根据图示,图中①仪器是酸式滴定管;氢氧化钠溶液是碱性溶液,用碱式滴定管,碱式滴定管排气泡的方法是:把滴定管的胶头部分向上弯曲,再排气泡,所以用③的方法;(3)H2O2用二氧化锰做催化剂可以分解为水和氧气,所以除去过量H2O2的方法是加入二氧化锰并振荡;(4)酚酞在酸性溶液中呈无色,在碱性溶液中为红色,滴定的终点现象是滴入最后一滴溶液,锥形瓶溶液由无色变为浅红色且半分钟不褪色;滴定管0刻度线在上方,尖嘴部分没有刻度线,若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积>40 mL,选④;(5)第一次实验数值偏离正常误差范围,根据第二次、第三次实验数据,平均消耗氢氧化钠溶液的体积是20.00 mL,设300.00ml葡萄酒中含SO2的质量为ag

a=0.0768g
所以该葡萄酒中SO2含量为![]() 0.2560 g/L;(6)盐酸挥发进入B瓶中与氢氧化钠反应,所以测定结果不能说明该葡萄酒中SO2残留量一定超标,改进方法是用硫酸代替盐酸,排除盐酸挥发的影响;
0.2560 g/L;(6)盐酸挥发进入B瓶中与氢氧化钠反应,所以测定结果不能说明该葡萄酒中SO2残留量一定超标,改进方法是用硫酸代替盐酸,排除盐酸挥发的影响;