题目内容
【题目】汽车尾气中的主要污染物是NO和CO。为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)已知:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2C(s)+O2(g)![]() 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
C(s)+O2(g)![]() CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则N2(g)+O2(g)═2NO(g) △H=____________ kJ/mol
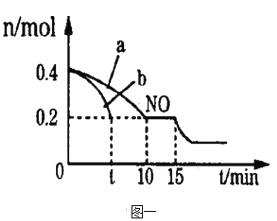
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
则C2较合理的数值为_________(填字母标号)
A.4.20 B.4.00 C.2.95 D.2.85
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO2(g) ![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO | H2 | |||
i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
iii | 900 | a | b | C | d | 1 |
若a=2,b=1,则c=____,三组实验对应平衡常数的关系K(i)_____ K(ii) _____ K(iii)(填“>”、“<”或“=”)。
(4)控制反应条件,CO和H2可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比
CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比![]() 的变化如图所示:
的变化如图所示:

①合成二甲醚的最佳氢碳比为__________。
②甲醇使用不当会导致污染,可用电解法消除这种污染。其原理是电解CoSO4、稀硫酸和CH3OH的混合溶液,将Co2+氧化为Co3+,Co3+再将CH3OH氧化成CO2,Co3+氧化CH3OH的离子方程式为________________。
【答案】 +180.5 D 0.6 > = 1.0 6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】(1)已知:①2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=﹣746.5kJ/mol
2CO2(g)+N2(g) △H=﹣746.5kJ/mol
②2C(s)+O2(g)![]() 2CO(g) △H=﹣221 kJ/mol
2CO(g) △H=﹣221 kJ/mol
③C(s)+O2(g)![]() CO2(g) △H=﹣393.5 kJ/mol
CO2(g) △H=﹣393.5 kJ/mol
则依据盖斯定律,③×2-②-①得到:N2(g)+O2(g)=2NO(g)的△H=+180.5kJ/mol。
(2)由表中数据可知4s时反应到达平衡,1~3s内CO浓度变化量为3.05×10-3 mol/L-2.75×10-3 mol/L=3×10-4 mol/L,该2s内平均每秒内变化量为1.5×10-4 mol/L,随反应进行,反应速率减小,该2s中前1s内CO浓度变化量应大于1.5×10-4 mol/L,则2s时CO的浓度小于3.05×10-3 mol/L-1.5×10-4 mol/L=2.9×10-3 mol/L,故2s时CO的浓度应介于2.75×10-3 mol/L~2.9×10-3 mol/L之间,选项中只有2.85×10-3 mol/L符合,答案选D。
(3) H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 0.5 1 0 0
转化浓度(mol/L) 0.2 0.2 0.2 0.2
平衡浓度(mol/L) 0.3 0.8 0.2 0.2
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L)0.5-c/2 0.5-c/2 d/2 d/2
平衡浓度(mol/L)0.5+c/2 c/2 d/2 d/2/span>
所以0.5-c/2=d/2,则d=1-c,由平衡常数相等可知:  ,解得c=0.6;650℃时根据方程式可知
,解得c=0.6;650℃时根据方程式可知
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度(mol/L) 1 2 0 0
转化浓度(mol/L) 0.8 0.8 0.8 0.8
平衡浓度(mol/L) 0.2 1.2 0.8 0.8
平衡常数为![]() >
>![]() ,又因为平衡常数只与温度有关系,则三组实验对应平衡常数的关系K(i)>K(ii)=K(iii)。
,又因为平衡常数只与温度有关系,则三组实验对应平衡常数的关系K(i)>K(ii)=K(iii)。
(4)①根据图像可知氢碳比为1时合成二甲醚的转化率最高,则合成二甲醚的最佳氢碳比为1。②根据电子得失守恒、原子守恒以及电荷守恒可知Co3+氧化CH3OH的离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。